> Syndrome méningite-artérite répondant à l'administration de corticoides
Saint Priest France
I- Introduction
Le syndrome méningite-artérite répondant à l’administration de corticoïdes (ou SRMA pour Steroid-Responsive Meningitis-Arteritis) est un désordre à médiation immunitaire caractérisé par une inflammation sévère des méninges et des artères associées. Ce syndrome est observé habituellement chez les jeunes chiens de moins de 2 ans en particulier de race Beagle, Boxer et Bouvier bernois. Deux formes distinctes sont décrites. La forme aiguë, la plus typique, est caractérisée par une raideur cervicale, des douleurs, une hyperthermie et une pléïocytose neutrophilique dans le liquide cérébrospinal (LCS). La forme chronique, plus rare, peut être associée à des déficits neurologiques. Le traitement repose sur une corticothérapie de longue durée débutée à doses immunosuppressives. Le pronostic pour les animaux traités en phase aiguë et de façon adaptée est bon. En revanche, lorsque le diagnostic est tardif et que la maladie est plus avancée, le pronostic est réservé et l’utilisation de traitements immunomodulateurs s’avère souvent nécessaire.
II- Physiopathologie
Le syndrome méningite-artérite est responsable d'une inflammation sévère des leptoméninges et des artères associées entraînant une méningite généralisée avec des signes neurologiques et une réponse inflammatoire systémique. L'étiologie et la pathogénie exacte de ce syndrome est inconnue mais une origine à médiation immunitaire est suspectée et supportée par une réponse à un traitement corticoïde à doses immunosuppressives. La présence de lymphocytes T activés chez les individus malades laisse penser à une réponse suite à un contact avec un stimulus antigénique bien qu’aucun élément infectieux ou environnemental n’ait jamais été mis en évidence. Des facteurs génétiques sont également suspectés, en particulier chez le Retriever de Nouvelle-Écosse.
III- Prédispositions
Tous les chiens peuvent être affectés par ce syndrome mais une prédisposition raciale existe chez les beagles, bouviers bernois, boxers, retrievers de Nouvelle Écosse et braques de Weimar. D’autres études mentionnent également d’autres races prédisposées (border collie, Springer anglais, golden retriever, griffons Korthals…) [1]. Les signes cliniques surviennent habituellement chez les animaux de moins de 2 ans. La médiane d’âge d’apparition des signes cliniques se situe entre 9 et 11 mois. Les mâles seraient plus fréquemment atteints que les femelles (58% mâles versus 42% femelles)
IV- Signes cliniques
Le syndrome méningite artérite se manifeste le plus souvent par un épisode de douleur cervicale aigu associé à un abattement soudain et une hyperthermie (> 39°C). L’ensemble des signes cliniques pouvant être observés sont mentionnés dans le tableau 1.
Deux formes cliniques sont décrites.
- Une forme aiguë dite classique, plus fréquemment rencontrée
L’inflammation méningée est à l’origine d’une hyperesthésie spinale, d’une raideur cervicale, d’une démarche raide et d’une hyperthermie. Les chiens peuvent être tellement douloureux que la moindre manipulation suscite une manifestation de douleur. L’analyse du LCS est caractérisée par une pléïocytose neutrophilique marquée, un taux protéique élevé et parfois la présence de globules rouges (suite aux dommages vasculaires provoqués par l’artérite).
- Une forme chronique, plus rare
Cette forme survient en particulier lors de la de mise en place d’un traitement inadapté ou en cas de rechute de la forme aiguë. L’inflammation chronique méningée peut entraîner une fibrose des méninges. Cliniquement, la forme chronique se manifeste par une série d'épisodes de douleur cervicale. Des déficits neurologiques compatibles avec une lésion médullaire tels qu’une parésie ou une ataxie sont parfois observés. Le LCS est composé de cellules mononucléaires ou d’une population de cellules mixte ; la protéinorachie est normale ou légèrement élevée.
V- Diagnostic
Il n'existe pas de test diagnostic définitif ante-mortem. Le diagnostic se base sur la présentation clinique, les analyses de laboratoire, l'exclusion d'autres affections et la réponse à un traitement corticoïde.
- Analyses sanguines : le bilan hématologique montre dans près de 90% des cas une leucocytose neutrophilique modérée à marquée avec un virage à gauche. La protéine C réactive (CRP) est fréquemment élevée, souvent supérieure à 60 mg/L pour la forme aiguë [2].
- Prélèvement de LCS : l'analyse du LCS met en évidence une inflammation méningée (pléïocytose) avec une augmentation du taux de protéines (protéinorachie). Lors de forme aiguë, le liquide est majoritairement composé de cellules neutrophiliques. Lors de forme chronique, le LCS est moins modifié et les anomalies sont moins spécifiques avec une population cellulaire plus hétérogène (cellules mononuclées ou pléïocytose mixte). La ponction de LCS doit être réalisée avant la mise en place de tout traitement sous peine d'avoir un résultat faussement négatif.
- Examens d’imagerie : les radiographies de la colonne cervicale sont habituellement normales. Un examen tomodensitométrique (scanner) révèle parfois une prise de contraste des méninges. L’imagerie par résonance magnétique (IRM) de la région cervicale peut mettre en évidence des signes de méningite avec notamment une prise de contraste marquée et épaississement des méninges parfois accompagné d'un réhaussement de la synovie des facettes articulaires et/ou un réhaussement musculaire [3]. Enfin, les modifications à l’échographie cardiaque sont fréquentes avec notamment un contraste spontané, une légère effusion péricardique et une diminution de la fraction d’éjection [4]. Des troubles du rythme sont également possibles.
VI- Traitement et pronostic
Le traitement repose essentiellement sur l’administration de corticostéroïdes (prednisolone) ainsi que l’utilisation de molécules immunomodulatrices au besoin.
Le traitement corticoïde est mis en place pour une durée minimale de 6 mois. La prednisolone est débutée à 2 mg/kg/jour pendant une à deux semaines puis diminuée à 1 mg/kg/jour. Il est recommandé de suivre le chien en clinique toutes les 4 à 6 semaines et de contrôler la CRP régulièrement. Les posologies sont diminuées graduellement selon l’évolution clinique et biologique jusqu’à une dose de 0,5 mg/kg toutes les 48 à 72h. Une ponction de LCS de contrôle peut être proposée afin de s’assurer de la guérison avant l’arrêt définitif du traitement.
Pour les formes chroniques ou les cas réfractaires, l’utilisation d’un immunomodulateur conjointement avec les corticoïdes est indiquée. Le plus utilisé est l’azathioprine (2 mg/kg/jour pendant 1 mois puis 2 mg/kg toutes les 48h pendant 2 mois). Une étude récente a également évalué l’efficacité de la cytarabine par voie sous cutanée ou intraveineuse.
Le pronostic est généralement bon pour les formes aiguës et si les animaux sont traités précocement et de façon agressive. Les récidives sont fréquentes (20 à 30% des cas) d’où l’importance de poursuivre le traitement pendant plusieurs mois, même en l’absence de signe clinique. Les Bouviers Bernois ont tendance à répondre moins favorablement au traitement que les autres races.
| Signes cliniques fréquents (> 60% des cas) |
Douleur cervicale Abattement Difficulté à se lever ou à marcher Démarche raide Hyperthermie ≥ 39°C Baisse d’appétit |
| Signes cliniques occasionnels |
Dos rond Douleur thoracolombaire |
| Signes cliniques rares (< 15% des cas) |
Tremblements Diarrhée Vomissements Mictions inappropriées |
Bibliographie
- Lau J et coll. Clinical characteristics, breed differences, and quality of life in North American dogs with acute steroid-responsive meningitis-arteritis. J Vet Intern Med. 2019 ; 33(4) : 1719-27.
- Andersen-Ranberg E et coll. Biomarkers of non-infectious inflammatory CNS diseases in dogs: Where are we now? Part 2 - Steroid responsive meningitis-arteritis. Vet J. 2021 ; 273.
- Remelli C et coll. Magnetic resonance imaging highlights the meningeal involvement in steroid responsive meningitis-arteritis and suggests the inflammation of the surrounding tissues (70 cases). Front Vet Sci. 2022 ; 19 : 9
- Spence S et coll. The occurrence of cardiac abnormalities in canine steroid-responsive meningitis arteritis. J Small Anim Pract. 2019 ; 60(4) : 204-11.
- Tipold A et coll. An update on steroid responsive meningitis-arteritis. J Small Anim Pract. 2010 ; 51(3) : 150-4.
> Polyarthrite et autres atteintes inflammatoires
Paris France
I- Introduction
Le syndrome fébrile associé à un état algique peut représenter un motif fréquent de consultation chez les jeunes animaux, surtout dans l’espèces canine. Parmi toutes ces causes, les ostéopathies juvéniles (ostéopathie métaphysaire et panostéite), la polyarthrite à médiation immune, le syndrome de méningo-artérite et, en moindre mesure, l’ostéomyélite sont les plus fréquemment diagnostiquées.
II- L’ostéopathie métaphysaire
Aussi appelée ostéodystrophie hypertrophique, cette affection représente une maladie orthopédique de croissance. Elle touche prioritairement les jeunes chiens (entre 2 et 8 mois d’âge) de grande race et de race géante. Les mâles sont surreprésentés, surtout ceux appartenant à certaines races (Berger allemand, Golden Retriever, Setter irlandais et, surtout, le Braque de Weimar). Bien que plusieurs étiologies aient été mises en cause (bactériennes, virales, inflammatoires, métaboliques, nutritionnelles et vasculaires), aucune preuve scientifique n’existe à ce jour plaidant en leur faveur. Cliniquement, l’ostéopathie métaphysaire se caractérise par un gonflement de la métaphyse distale (en moindre mesure proximale) du radius, de l’ulna et du tibia, associé à un état algique et, parfois, à un syndrome fébrile. Le diagnostic est radiographique, avec des lésions devenant visibles environ 24 à 28 heures après la survenue des signes cliniques. Le traitement est médical et symptomatique, incluant le repos et, éventuellement, l’utilisation d’anti-inflammatoires non stéroïdiens. Dans les cas (plus rares) de douleur intense, une hospitalisation et l’administration d’une analgésie sont nécessaires. A noter que chez le Braque de Weimar les glucocorticoïdes sembleraient être plus efficaces. Les antibiotiques n’ont aucun intérêt. Les signes cliniques ont tendance à disparaitre en 7 à 10 jours, bien que des récidives soient possibles tout au long de la croissance de l’animal. Cette affection est à différencier du syndrome d’Alamartine-Ball-Cadiot et de l’ostéomyélite.
III- La panostéite
Aussi appelée ostéomyélite juvénile ou ostéodystrophie fibrose, la panostéite représente une inflammation du tissu adipeux de la moelle osseuse des os longs, qui est temporairement remplacée par du tissu fibreux. Les chiens atteints sont le plus fréquemment jeunes (moins de 18 mois d’âge) et le Berger allemand et le Basset Hound sont les races les plus touchées. Les mâles sont de nouveau surreprésentés. Comme pour l’ostéopathie métaphysaire, aucune étologie certaine n’a été mise en évidence, bien que des causes immunitaires, vasculaires, parasitaires, endocriniennes ou hématologiques aient été avancées. Aucun élément scientifique probant n’existe à ce jour prouvant un rôle des infections bactériennes, ni virales dans la pathogénie de la panostéite. Cliniquement, une boiterie, un état algique et un syndrome fébrile sont rapportés. Les membres antérieurs semblent être les plus fréquemment touchés. Dans la moitié des cas, plusieurs membres et plusieurs os du même membre sont atteints. A noter qu’une dysplasie du coude et/ou une dysplasie de la hanche est/sont également présente(s) dans environ 25% des cas. Le diagnostic est radiographique, avec des lésions devenant radiographiquement visibles environ 10 à 15 jours après la survenue des signes cliniques et se résolvant en 4 à 6 semaines (la résolution complète des anomalies radiographiques pouvant nécessiter plusieurs mois). La panostéite est auto-résolutive et le traitement est symptomatique, avec utilisation d’anti-inflammatoires non stéroïdiens. Cette affection est à différencier de la polyarthrite à médiation immune et de l’ostéochondrose dissecante.
IV- La polyarthrite à médiation immune
1. Chien
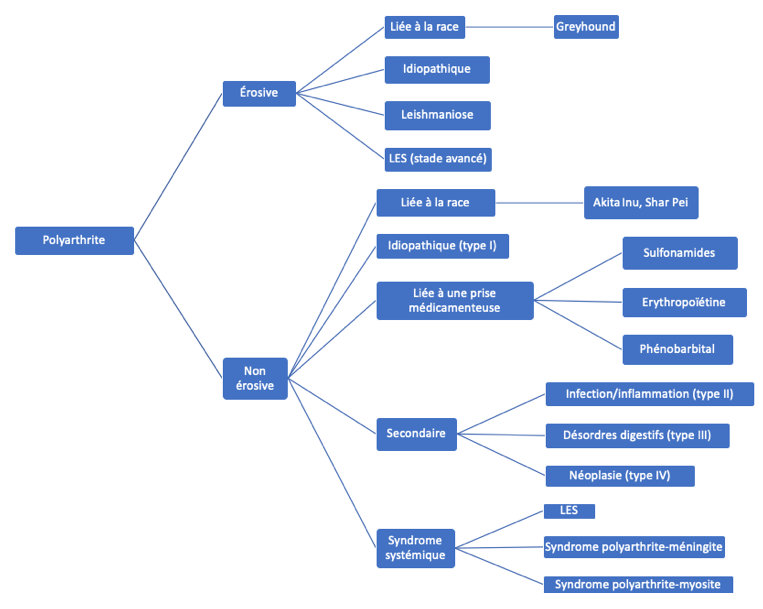
Les polyarthrites à médiation immune (PAMI) représentent des arthropathies s’insérant dans le chapitre général des arthralgies. Elles sont à différencier des phénomènes arthrosiques, de l’ostéomyélite, de la panostéite, des néoplasies et de l’hémarthrose. Les PAMI se caractérisent par une inflammation neutrophilique synoviale aseptique de deux ou plusieurs articulations, dont le mécanisme pathogénique repose sur le dépôt de complexes immuns en regard de la membrane synoviale. Les PAMI sont classifiées en érosives (PAMI rhumatoïde) et non érosives. Ces dernières, plus fréquentes, sont ensuite classifiées en associatives (secondaires à un foyer inflammatoire, infectieux ou tumoral en dehors des articulations, ou dues à une prise médicamenteuse) ou non associatives (également appelées primaires ou idiopathiques) (Figure 1). À différence des PAMI non érosives, les PAMI érosives sembleraient être uniquement primaires, à l’exception de la polyarthrite érosive associée à la leishmaniose ou aux stades avancés de PAMI associée au lupus érythémateux systémique. Les polyarthrites peuvent être rencontrées chez des chiens de tout âge, mais les PAMI non érosives sont le plus souvent rencontrées chez la femelle jeune adulte. L’arthrite rhumatoïde, plus rare, est surtout observée chez des chiens de petit format et d’âge moyen. À l’examen clinique, la douleur articulaire domine le tableau clinique et est responsable de boiteries et de raideurs. Une cervicalgie est aussi parfois rencontrée, secondaire à l’atteinte des facettes articulaires intervertébrales, ainsi qu’une douleur à l’ouverture de la cavité buccale, témoignant d’une atteinte de l’articulation temporo-mandibulaire. D’autres signes cliniques peuvent être présents, tels qu’un syndrome fébrile ou une intolérance à l’effort. Les articulations les plus distales (carpes et tarses) sont les plus affectées. Dans les cas où des déformations articulaires sont présentes, l’examen radiographique permet d’objectiver des érosions articulaires permettant un diagnostic de PAMI érosive. Le diagnostic de PAMI (primaire ou secondaire) repose sur l’examen du liquide articulaire prélevé sur autant d’articulations que possible. Par la suite, la différenciation entre PAMI primaire et secondaire nécessite une anamnèse minutieuse (utile à écarter l’hypothèse de PAMI due à une prise médicamenteuse et pour connaitre le contexte épidémiologique du patient) et la réalisation de plusieurs examens complémentaires (analyse urinaire, hémogramme, biochimie sanguine complète, ionogramme avec dosage du calcium ionisé, radiographies thoraciques et échographie abdominale a minima), afin d’infirmer (PAMI primaire) ou de confirmer (PAMI secondaire) l’existence d’un foyer infectieux, inflammatoire ou tumoral à distance, ou la présence d‘une maladie vectorielle active (PAMI secondaire) ou inactive (PAMI primaire, définie comme étant « post-infectieuse »). Dans le cadre du traitement, l’analgésie est essentielle. Une antibiothérapie avec doxycycline est également très souvent prescrite, son utilisation reposant sur la possible incrimination d’un agent vectorisé. L’immuno-modulation est l’élément clé dans le traitement des PAMI primaires. La prednisolone demeure la molécule la plus utilisée (à proscrire en cas de PAMI érosive, pour lesquelles le léflunomide est préférable selon l’expérience de l’auteur).
Classification et causes des polyarthrites canines
2. Chat
Chez le chat, à la différence du chien, les polyarthrites infectieuses sont plus fréquentes que celles à médiation immune (primaires ou secondaires). Parmi les agents infectieux, les bactéries (dont les bactéries L-forme), Mycoplasma spp, Calicivirus, Coronavirus, Cryptococcus, Histoplasma spp et certaines rickettsiae sont les plus souvent rencontrés. Ces agents induisent directement une inflammation synoviale, à l’origine d’une polyarthrite non-érosive (à l’exception de Mycoplasma spp). Néanmoins, le dépôt de complexes immuns circulants sur la membrane synoviale (secondaire à une infection systémique) est aussi possible. Une boiterie est possible, mais le tableau clinique est le plus souvent caractérisé par une « faiblesse », décrite par les propriétaires comme une incapacité à sauter et une prostration plus ou moins marquée. D’autres signes moins spécifiques sont souvent rencontrés, tels qu’un syndrome fébrile. La démarche diagnostique repose avant tout sur la mise en évidence d’une polyarthrite, après réalisation de plusieurs arthrocentèses avec examen cytologique du liquide synovial. La recherche d’un agent infectieux est fortement recommandée chez le chat, à la fois systémique et intra-auriculaire. La réalisation d’un test rapide (voire d’une PCR) pour la mise en évidence de FIV et/ou FeLV est aussi conseillée. De nouveau, la prise en charge de la douleur est fondamentale. Le traitement spécifique dépendra de la mise en évidence ou pas d’un agent infectieux, ainsi que de l’intérêt d’un traitement immuno-modulateur dans les cas de polyarthrite à médiation immune primaire ou secondaire. La prednisolone reste la molécule de choix dans ces derniers cas de figure, pouvant être associée (ou remplacée) par la cyclosporine.
Classification et causes des polyarthrites félines
Arthrites infectieuses
- bactérienne (polyarthrite septique) ;
- Mycoplasma spp (possiblement érosive) ;
- bactéries L-forme ;
- Streptococcus groupe G ;
- Calicivirus ;
- Coronavirus ;
- Rickettsiae (Anaplasma phagocytophilum et Ehrlichia spp) ;
- Bartonella burgdoferi ;
- mycoses.
Arthrites non-infectieuses
Érosives
- polyarthrite chronique progressive (surreprésentée chez les Siamois) ;
- polyarthrite pseudo-rhumatoïde.
Non-érosives
- idiopathique (nécessite d’exclure tout autre cause) ;
- réactionnelle (cf polyarthrites du chien) ;
- lupus érythémateux systémique.
Bibliographie
- Kieves NR. Juvenile Disease Processes Affecting the Forelimb in Canines. Vet Clin Vet Clin Small Anim 2021 ;51 : 365-382.
- Jacques D et al. A Retrospective Study of 40 Dogs With Polyarthritis. Vet Surg 2002 ; 31 : 429-434.
- Rondeau MP, et al. Suppurative, Nonseptic Polyarthropathy in Dogs. J Vet Intern Med 2005; 19: 654-662.
- Sbrana S et al. Retrospective study of 14 cases of canine arthritis secondary to Leishmania infection. J Small Anim Pract 2014; 55: 309-313.
- Lemetayer J, Taylor S. Inflammatory joint disease in cats: diagnostic approach and treatment. J Feline Med Surg 2014; 16: 547-62.
> Syndrome fébrile : démarche clinique
Paris France
Les termes « hyperthermie » et « fièvre » indiquent de façon équivalente une augmentation de la température corporelle. Néanmoins, une différence existe entre ces deux phénomènes, liés aux mécanismes physiologiques à l’origine de l’augmentation de la température corporelle. La fièvre représente une augmentation de la température corporelle en réponse à une élévation de la « valeur seuil » de l’hypothalamus. L’hyperthermie, en revanche, représente une augmentation de la température corporelle secondaire à un déficit de dissipation de la chaleur, sans altération de la « valeur seuil » hypothalamique (Figure 1). Le plus souvent, la fièvre ne dépasse pas les 40,1°C (car l’organisme est capable de produire des anti-pyrogènes, tels que l’IL-10 et les glucocorticoïdes endogènes), tandis que l’hyperthermie se présente avec des températures corporelles variant entre 40,5°C et 43°C.
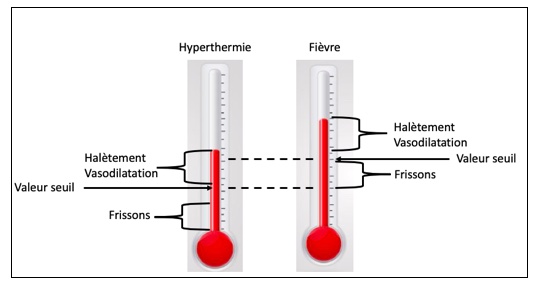
Figure 1
Le mécanisme à l’origine de la fièvre est la production de pyrogènes. Il s’agit de petits polypeptides (IL-1 > TNF > IL-6 > IFN > MIP), produits en réponse à différentes molécules, dont les agents infectieux ou les toxines. Ces pyrogènes (en association avec les prostaglandines produites par l’endothélium vasculaire) vont rentrer en contact avec la seule partie du SNC qui est dépourvue de barrière hémato-encéphalique (organa vasculosum de la lamina terminalis de l’hypothalamus). Au moment de cette rencontre, des prostaglandines E2 sont produites, induisant une augmentation de la « valeur seuil » hypothalamique. C’est pour cette raison que les animaux ayant une fièvre présentent des frissons, puisque tous les mécanismes utiles à garder la chaleur sont activés en réponse à l’augmentation de la « valeur seuil ». De la même façon, tous les mécanismes utiles à dissiper la chaleur seront activés seulement si la température dépasse la nouvelle valeur seuil.
Les causes les plus fréquentes de fièvre chez le chien (Tableau 1) et le chat (Tableau 2) incluent les infections (bactériennes, virales, protozoaires, vectorielles et fongiques), les maladies à médiation immune (primaire ou secondaire), les néoplasies et les foyers inflammatoires. Plus rarement, d’autres maladies ont été décrites (insuffisance hépatique, hypocobalaminémie congénitale), sans que le mécanisme exact à l’origine de la fièvre soit connu. Plusieurs études ont été publiées dans le but de rechercher les causes de fièvre les plus fréquentes chez les animaux domestiques. De la lecture de ces études il en découle que les causes de fièvre les plus fréquentes sont les maladies inflammatoires non infectieuses (et principalement les maladies à médiation immune) chez le chien et les infections chez le chat.
Tableau 1. Causes de fièvre chez le chien
Infection systémique :
- virale : maladie de Carré ;
- bactérienne : borréliose, leptospirose, brucellose, bactériémie ;
- fongique : cryptococcose, aspergillose, histoplasmose, blastomycose, coccidiomycose ;
- protozoaire : babésiose, leishmaniose, toxoplasmose, néosporose, hépatozoonose ;
- rickettsie : ehrlichiose, anaplasmose, hémobartonellose ;
- parasitaire : angiostrongylose, dirofilariose cardiaque.
Infection localisée :
- appareil cardiovasculaire : endocardite (aortique/pulmonaire >>> mitrale/tricuspide) ;
- appareil myo-arthro-squelettique : spondylodiscite, ostéomyélite, arthrite septique, maladies vectorielles ;
- appareil uro-génital : pyélonéphrite, prostatite, pyomètre, orchi-épidydimite ;
- appareil respiratoire : pyothorax, pneumonie, abcès pulmonaire ;
- appareil digestif : abcès dentaire, cholangite ; hépatite, abcès hépatique, pancréatite ;
- divers : péritonite, abcès occulte.
Maladies à médiation immune :
- polyarthrite ;
- lupus érythémateux systémique ;
- méningoencéphalite ;
- vascularite ;
- anémie hémolytique ;
- thrombopénie ;
- panostéite/ostéodystrophie hypertrophique ;
- panniculite/cellulite juvénile ;
- immunodéficience relative à la race (Teckel et Cavalier King Charles).
Myelophtisie ou dysmyelopoïèse :
- leucémie ;
- myélome multiple ;
- macroglobulinémie de Waldestrom ;
- lymphome ;
- myélodysplasie.
Néoplasies :
- tumeur nécrosée ;
- lymphome ;
- histiocytose maligne ;
- adénocarcinome hépatique.
Divers :
- médicaments et toxiques : tétracyclines, pénicillines, sulfamides, quinidine, phénobarbital, lévamisole, kétamine, organophosphorés ;
- shunt porto-systémique ;
- hypocobalaminémie congénitale ;
- thrombo-embolie pulmonaire ;
- fièvre familiale du Shar Pei.
Tableau 2. Causes de fièvre chez le chat
Infection systémique :
- virale : péritonite infectieuse fémine (PIF), infection par le FeLV ou FIV, viroses respiratoires, panléucopénie ;
- bactérienne : foyers infectieux intra-thoraciques, intra-abdominaux ou cutanés ; mycoplasmose à Mycoplasma haemofelis ;
- fongique : cryptococcose ;
- protozoaire : babesiose, leishmaniose, toxoplasmose, hépatozoonose ;
- rickettsie : ehrlichiose, anaplasmose ;
- parasitaire : troglostrongylose ; douves hépato-pancréatiques.
Infection localisée :
- appareil cardiovasculaire : endocardite (rarissime) ;
- appareil myo-arthro-squelettique : ostéomyélite ; arthrite septique ;
- appareil uro-génital : pyélonéphrite ; pyomètre ;
- appareil respiratoire : pyothorax, pneumonie, abcès pulmonaire ;
- appareil digestif : abcès dentaire ; stéatose hépatique ; cholangite ; abcès hépatique/pancréatique ; triade féline ;
- divers : péritonite ; abcès occulte.
Maladies à médiation immune :
- polyarthrite à médiation immune secondaire (virose, mycoplasmose à Mycoplasma spp) ;
- lupus érythémateux systémique (rarissime) ;
- anémie hémolytique (ou autres cytopénies) ;
- immunodéficience (FIV).
Myélophtisie ou dysmyélopoïèse :
- leucémie ;
- myélome multiple ;
- macroglobulinémie de Waldestrom ;
-lymphome ;
- myélodysplasie ;
- syndrome myéloprolifératifs (FeLV).
Néoplasies :
- tumeur nécrosée ;
- lymphome ;
- processus néoplasique métastasé.
Divers :
- médicaments et toxiques : tétracyclines, pénicillines, sulfamides, quinidine, cimétidine, phénobarbital, salycylés, kétamine, prednisone, antihistaminiques.
Par ailleurs, on parlera de fièvre d’origine inconnue (FOI) lorsqu’une fièvre est présente depuis au moins 2 semaines, et pour laquelle un minimum d’investigations n’a pas permis d'en déterminer la cause. Les causes d’hyperthermie sont moins nombreuses et incluent : l’augmentation de la température environnementale (particulièrement en cas d’humidité excessive), l’exercice intense, les crises convulsives, les désordres hyper-métaboliques (hyperthyroïdie, hypocalcémie etc), certains médicaments (la kétamine chez le chat, par exemple), le stress et l’hyperthermie maligne. Certains facteurs (tel que l’obésité) ou certaines maladies à l’origine d’une sub-obstruction des voies respiratoires hautes (collapsus laryngé, par exemple) peuvent augmenter le risque d’hyperthermie en cas de température/humidité environnementales plus élevées.
En cas de fièvre persistante ou récurrente, après avoir réalisé un recueil minutieux de l’anamnèse et un examen clinique rigoureux, les examens complémentaires seront réalisés par étape (Figure 2). À ce stade, tout médicament doit être arrêté (et a fortiori ceux pouvant avoir un effet pyrétogène). Il est par ailleurs important de noter que la durée des investigations complémentaires pour aboutir au diagnostic d’une fièvre chez les chiens est significativement plus longue chez ceux qui ont reçu un traitement symptomatique dans les 24 heures précédant leur arrivée dans un centre de référés. Chez les chats, l’administration préalable de médicaments ne semble pas influencer la durée de la démarche diagnostique.
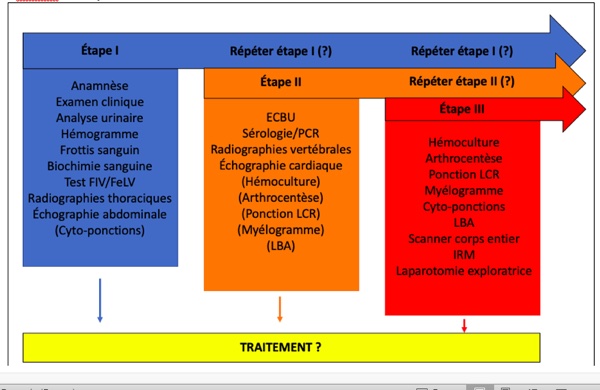
Figure 2
Un examen clinique attentif et exhaustif est la pierre milliaire de toute démarche diagnostique, car il posera les bases pour un choix logique des éventuels examens complémentaires à réaliser. Une attention particulière sera réservée à l’appareil tégumentaire (à la recherche de morsures ou d’abcès) et à la sphère oro-pharyngée (présence éventuelle d’érosion/ulcération de la langue en cas de virose ; couleur pâle/jaune des muqueuses en cas d’anémie centrale et/ou hémolytique) chez le chat, tandis que la recherche de corps étrangers migrants (particulièrement pendant l’été), ainsi que de signes d’affection de l’appareil génito-urinaire (pour la spondylodiscite ou la pyélonéphrite), ostéo-articulaire (pour les polyarthrites à médiation immune idiopathiques ou les affections osseuses juvéniles) ou hématopoïétique (anémie hémolytique ou thrombopénie à médiation immune, principalement) sera nécessaire chez le chien. Si, à l’issue d’un examen clinique complet, aucune affection causale ne peut être suspectée, il parait raisonnable de suivre l’évolution de la fièvre (au domicile ou en hospitalisation), avec un suivi régulier de la température corporelle. Chez le chat, dans la majorité des cas (et notamment lors de primo-infection virale) la fièvre rétrocède spontanément après quelques jours.
Bibliographie
- Black VL, Whitworth FJS, Adamantos S. Pyrexia in juvenile dogs: a review of 140 referred cases. J Small Anim Pract 2019;60:116-120.
- Klein BG. Thermoregulation. Dans: Klein BG Ed. Cunningam’s Textbook of Veterinary Physiology, 5thEd. St. Louis, Missouri: Elsevier; 2013. P. 559-568.
- Mazzaferro EM. Heatstroke. Dans : Ettinger SJ, Feldman EC, Côté E, Eds. Textbook of Veterinary Internal Medicine: Diseases of the Dogs and Cats, 8th Ed. St. Louis, Missouri: Elsevier; 2017. p. 562-566.
- Ramsey IK & Tasker S. Fever. Dans : Ettinger SJ, Feldman EC, Côté E, Eds. Textbook of Veterinary Internal Medicine: Diseases of the Dogs and Cats, 8th Ed. St. Louis, Missouri: Elsevier; 2017. p. 195-200.
- Spencer SE, Knowles T, Ramsey IK, Tasker S. Pyrexia in cats: Retrospective analysis of signalment, clinical investigations, diagnosis and influence of prior treatment in 106 referred cases. J Fel Med Surg 2017;19:1123-1130.
