> Anesthésie du patient atteint d'un shunt porto-systémique
Toulouse
I- Introduction
Les shunts porto-systémiques (SPS) sont des anomalies vasculaires entre la circulation portale et la veine cave caudale qui détournent le flux sanguin en provenance du système digestif du premier passage hépatique. La grande majorité de ceux nécessitant une intervention chirurgicale sont congénitaux et seront donc ceux auxquels nous ferons référence. Au risque hémorragique la nature intra ou extra-hépatique du shunt fait peu de différence en anethésie. Les substances normalement métabolisées par le foie (acides aminés, ammonium, faux neurotransmettreurs) se retrouvent en quantité anormale dans la circulation générale et sont à l’origine des divers symptômes observés.
La présentation clinique est variable allant d’un léger retard de croissance au status epilepticus. Les signes cliniques frustes peuvent passer inaperçus de sorte que la suspicion clinique intervient souvent durant la stérilisation avec un réveil d’anesthésie anormalement prolongé. Un bilan pré-anesthésique de routine avant stérilisation peut cependant soulever cette suspicion (anémie, hypoprotidémie/albuminémie, hypoglycémie, hypo-urémie). Le diagnostic de certitude et le bilan lésionnel complet reposent sur une exploration systématisée incluant notamment des bilans biochimiques spécifiques mais surtout des examens d’imagerie. Leur importance est double : d’une part la caractérisation du shunt (sévérité et conséquences) et d’autre part le fait que l’imagerie nécessite souvent une anesthésie (scanner).
II- Particularités physiopathologiques du patient atteint de SPS
Généralement, le foie des patients est sain, mais hypoperfusé ce qui entraine son hypoplasie. La veine porte assurant normalement les 2/3 de sa perfusion, l’artère hépatique prend partiellement le relai et permet de maintenir un flux sanguin suboptimal, suffisant à la survie du tissu. En revanche, cela ne permet pas de compenser la perte de l’effet du premier passage hépatique, d’autant plus altéré que la fraction portale shuntée est importante. L’accumulation des toxines serait en partie à l’origine de l'encéphalose hépatique, dont l’importance est fondamentale pour la prise en charge globale du patient. En médecine humaine tant que vétérinaire, son origine est mal connue et sa physiopathologie incertaine. Le NH3 accumulé est certes neurotoxique, mais les symptômes seraient aggravés par l’inflammation chronique consécutive à l’hypoperfusion hépatique et une augmentation de la perméabilité de la barrière hémato-encéphalique aux différents neurotoxiques digestifs (NH3, glutamine, neurostéroïdes). Par ailleurs, on suspecte que la production de benzodiazépines endogènes contribuerait aux signes cliniques tels que l’hypovigilance. L'altération concomittante de la neurotransmission pourrait dans les cas les plus graves, précipiter des phénomènes d’œdème cérébral.
Les répercussions métaboliques en lien avec les médicaments de l'anesthésie s'articulent autour d'une double problématique : la diminution de la perfusion hépatique (empirant sa dysfonction) et la diminution de leur métabolisme du fait l’altération préalable de la fonction hépatique. Les tissus hépatiques les plus éloignés de la veine porte sont les plus actives mais aussi les moins bien perfusés, a fortiori en cas de shunt. Le foie de taille réduite ne possède pas des capacités normales, inversement proportionnelles à la gravité de l’atteinte. Les médicaments et doses doivent être judicieusement choisis en fonction de la procédure à envisager et de l’état clinique du patient. Un ajustement de la profondeur de narcose au plus près des besoins, en s’appuyant sur les concepts d’anesthésie balancée garantit au patient le réveil le plus optimal qui soit.
L'hypoplasie hépatique et les anomalies vasculaires conduisent également à une hypoglycémie, hypoalbuminémie, anémie, des troubles de la coagulation et de l’hypothermie pouvant rapidement se mettre en place.
III- Identifier les risques spécifiques liés au patient / à la procédure
Une stabilisation préalable à l’anesthésie vise principalement à diminuer les signes en lien avec l’hyperammoniémie : alimentation adaptée, antibiothérapie probabiliste, administration de lactulose, voire lavements coliques. Pour les shunts intra-hépatiques, des ulcérations digestives érosives justifient un traitement par inhibiteurs de la pompe à protons, conservé le jour de l’intervention. Un traitement préventif à la vitamine K ainsi qu'un groupage sanguin sont recommandés. Le lévétiracétam en prévention des convulsions et autre atteinte neurologique post-atténuation est encore recommandé bien que controversé. S’agissant d’un médicament anti-épileptique non conventionnel, une potentielle synergie avec les médicaments de l’anesthésie est à envisager.
Le jour de l’anesthésie, une examen clinique complet du patient est nécessaire pour détecter des anomalies persistantes et une éventuelle nécessité de correction. Même bien stabilisé, la décompensation peut être rapide car l'homéostasie précaire est mise à l’épreuve des médicaments de l’anesthésie. L'adapation de la prise en charge reste personnalisée au patient et à la procédure. Un minimal data base permet d'affiner les conséquences fonctionnelles de l’atteinte, en lien avec le succès relatif de la stabilisation médicale préalable :
- glycémie à jeun servant de base aux suivis réguliers à mettre en place durant l’anesthésie ; pour une valeur inférieure à 0.8 g/L, on initie un complémentation en glucose 2.5% et des contrôles réguliers (10-30 minutes selon la cinétique). (En cas d’hypoglycémie réfractaire, la mise en place de corticostéroïdes est envisagée).
- mesure Ht/PT (+/- lactates) permettant d'estimer l’état de perfusion du patient et déterminer l'importance d’une éventuelle anémie et de l’hypoprotidémie ; NB : l'albumine circulante étant un des ligands majoritaires des médicaments, un déficit marqué en augmente la fraction libre, rendant les patients vulnérables au risque de surdosage. Echographie POCUS abdominale lors d'ascite pré-existante ; elle s'accompagne d'un risque majoré d’hypoperfusion des organes par augmentation de la pression intra-abdominale, défaut de retour veineux et hypotension et d’hypoventilation par augmentation de la pression exercée sur le diaphragme.
- le NH3 et les anomalies du ionogramme doivent être corrigés.Face au risque hémorragique, en particulier pour les shunts intra-hépatiques, on répète un bilan de coagulation et anticipe le besoin transfusionnel : groupage, calcul de la volémie théorique du patient (90 mL/kg chez le chien, 60 chez le chat), limites acceptables de pertes (-10% avant réanimation liquidienne et -20-30% avant transfusion massive).
La perméabilité augmentée de la BHE va de pair avec des effets anesthésiques accrus. Ils sont de ce fait plus sensibles au risque d’hypotension et la surveillance de la pression artérielle (invasive) est obligatoire. Lors de l’occlusion du shunt la redirection massive d'une partie du retour veineux vers le foie peut entrainer une hypotension importante, transitoire qui nécessite surveillance et prise en charge en cas de persistance de troubles hémodynamiques supérieure à 5 minutes.
Le risque majeur d’hypothermie doit être pris en compte et traité de manière préventive car, en plus d’aggraver les risques de coagulopathie, d’hypotension, de défaut de cicatrisation… elle augmente la probabilité de réveil prolongé.
IV- Procédure anesthésique
Après évaluation du patient et identification des risques, il convient d'appliquer la démarche anesthésique systématique. En plus, chez l’insuffisant hépatique, on vise une diminution maximale de la charge métabolique du foie : médicaments d’action rapide, courte, réversible et en favorisant ceux qui possèdent des voies de métabolisation extra-hépatiques et l'anesthésie loco-régionale (ALR). Plus encore que d’habitude il s’agit de s'appuyer sur la multimodalité de l’analgésie et les adujvants en perfusion continue. Une titration fine des besoins en narcose est nécessaire pour maintenir l’animal grâce au minimum de gaz halogénés possible afin d’en limiter les effets non recherchés, en particulier la vasodilatation et hypothermie.
La prémédication répond au même cahier des charges qu'habituellement, tout en se limitant au strict nécessaire : sédation légère et analgésie préemptive en vue d’une intervention chirurgicale. On opte en général pour un opioïde à faible dose (méthadone, fentanyl). L’utilisation de benzodiazépine est controversée chez ces patients même si le niveau de preuve est faible ; on les réserve au traitement curatif des convulsions. Pour des animaux très stressés et/ou pour obtenir une sédation légère, la dexmédétomidine à faible dose en IM est une alternative correcte du fait de sa courte durée d’action,de ses propriétés sédatives et de sa réversibilité par l’atipamézole. NB : pour une anesthésie diagnostique, l’analgésie n’étant pas nécessaire, l’auteur évite l’administration d’opioïdes et utilise le propofol seul en induction, suivi d’une maintenance volatile. Par expérience, contrairement à des patients ‘sains’ les réveils restent de bonne qualité (si, et seulement si, le patient est calme au préalable, sinon cf. supra). Pour toute intervention chirurgicale, l’analgésie pré-emptive, adaptée et multimodale reste obligatoire.
Le propofol par titration est utilisé en induction puisqu’il possède des voies de métabolisation extra-hépatiques. On peut si besoin ajouter la kétamine en co-induction, cette dernière n’étant métabolisée qu’à 50 et 5% par le foie chez le chien et le chat respectivement : 1 à 2 mg/kg IV en fonction de la gravité de l'atteinte. Après intubation, la maintenance par voie inhalée est obligatoire : les agents volatiles sont très peu métabolisés par le foie et rapidement titrables à effet. L’isoflurane semblerait mieux préserver la perfusion hépatique mais le sévoflurane permet des ajustements du niveau de narcose plus rapides.
La gestion de l’analgésie est bien entendu primordiale : nociception importante du fait de la laparotomie haute, et bénéfice d'une analgésie adaptée sur la réduction des besoins en narcose. Ainsi, en plus des opioïdes, l'anesthésie locorégionale (ALR) présente de nombreux bénéfices. Non seulement elle permet une gestion de la nociception à la source mais réduit drastiquement la biodisponibilité des médicaments par rapport à leur administration systémique. L'épidurale haute de morphine a prouvé son efficacité dans la gestion de l’analgésie per et post-opératoire lors d’atténuation de SPS chez le chien et l’auteur préconise en plus la réalisation d’un bloc échoguidé des plans abdominaux transverses bilatéralement à la ligne blanche, désensibilisant efficacement et durablement la paroi abdominale dans la zone d’incision. A défaut le fentanyl peut être utilisé en perfusion continue mais à des doses et débits réduits pour en limiter l’accumulation. Une co-analgésie systémique à la kétamine à dose infra-anesthésique peut s’y ajouter.
Le monitoriage clinique et instrumental est primordial et centré sur la narcose et la sphère cardiovasculaire. On y ajoute, le suivi de la glycémie. Un soutien de la fonction respiratoire est parfois nécessaire via une ventilation assistée, particulièrement chez les grands chiens, afin de limiter le travail des muscles respiratoires et donc la surconsommation d’énergie, de glucose et d’oxygène. Une surveillance de la température et la mise en place de mesures de réchauffement actif sont indispensables dès la préparation chirurgicale puisqu'elle s’aggravera rapidement avec la mise en place de l’anesthésie et s'accompagne d'un risque de réveil prolongé.
Le réveil doit également être surveillé de près, le patient réchauffé et les éventuels troubles résiduels corrigés et ajustés jusqu’au réveil complet pour permettre une reprise des grandes fonctions aussi rapide que possible. Des convulsions au réveil sont parfois décrites et doivent être traitées de manière appropriée. On surveille également les signes d'hypertension portale.
Bibliographie sur demande
> Prise en charge chirurgicale des shunts porto-systémiques
Bordeaux France
I- Introduction
L'atténuation chirurgicale des shunts porto-systémiques congénitaux (SPS) est le traitement recommandé pour la plupart des cas afin de rétablir un flux sanguin portal normal. Une atténuation progressive utilisée dans le but de minimiser le risque de complications périopératoires d'hypertension portale (HP) est considérée comme le traitement de choix, et est associé à une durée de survie plus longue par rapport à la prise en charge médicale.
II- Localisation du shunt
Leur morphologie est complexe. Une compréhension approfondie de l'anatomie du foie et de sa vascularisation est essentielle (figure 1)
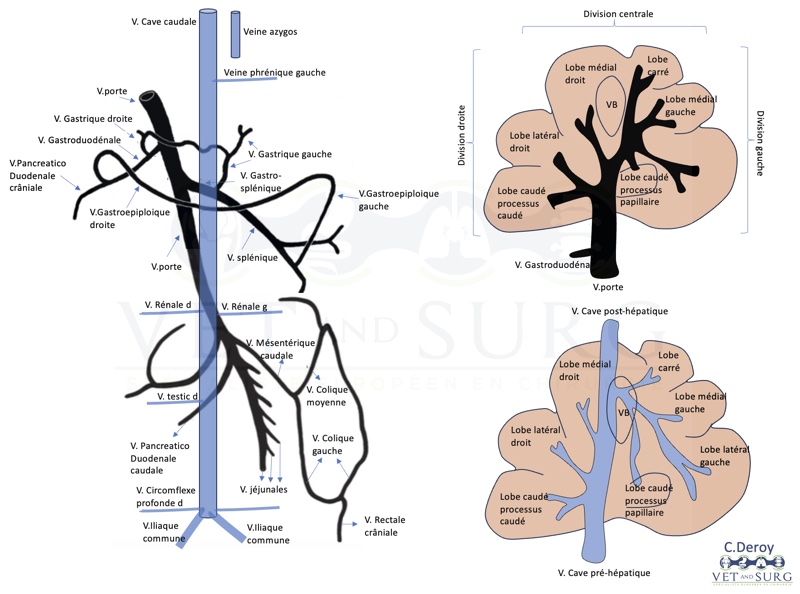
Figure 1
L'angioscanner constitue une méthode diagnostique précise pour le diagnostic des SPS, mais aussi pour la planification chirurgicale. La localisation des SPS se fait en chirurgie par visualisation directe, échographie, portographie ou par évaluation des variations de pression portale. Un shunt se dirigeant vers la veine cave caudale entraîne souvent un flux sanguin turbulent. La mesure de la pression portale en obstruant le shunt revêt une importance cruciale pour la localisation du shunt.
III- Les shunts extrahépatiques
- Les SPS extrahépatiques sont réduits le plus près possible de leur site d'insertion sur la veine systémique afin de permettre l'inclusion de toutes les branches du shunt.
- Les SPS extrahépatiques pré-hépatiques tels que le gastrocave et le splénocave sont occlus à leur abouchement dans la veine cave caudale (VCC), souvent situé en amont des veines rénales, au niveau du foramen épiploïque.
- Les SPS caudaux abdominaux (colique gauche) pénètrent dans la VCC caudalement aux veines rénales.
- Les SPS extrahépatiques post-hépatiques tels que le gastrophrénique et le gastroazygos (plus couramment observés) peuvent se rejoindre au niveau du diaphragme dans la veine phrénique, dans la veine cave (parfois en formant une ampoule) ou dans la veine azygos. Les shunts gastrophréniques sont identifiés près de la petite courbure de l'estomac, rejoignant la veine phrénique au niveau du diaphragme. Les shunts gastroazygos traversent le diaphragme et sont le plus souvent situés au niveau du hiatus aortique ou œsophagien. Le diaphragme peut être ouvert si une exposition plus importante est nécessaire.
IV- Les SPS intrahépatiques
L’occlusion du SPS intrahépatique est réalisée soit sur la veine porte qui irrigue le shunt, soit sur la veine hépatique gauche lors de SPS intrahépatique gauche. Les SPS intrahépatiques peuvent être localisés entre les lobes du foie ou être complètement entourés de parenchyme hépatique, ce qui les rend invisibles. Les veines hépatiques et portales liées à ces shunts peuvent être identifiées grâce à leur dilatation notable et à la présence d'un flux sanguin turbulent. Les SPS non apparents peuvent être identifiés par palpation du parenchyme hépatique qui est moins dense en regard du shunt. Les SPS intrahépatiques ont été classés suivant leur localisation en 3 types : divisions gauche, droite et centrale. Le shunt à division gauche est très souvent détecté en position posthépatique avec un abouchement dans la veine hépatique gauche. Les shunts intrahépatiques, contrairement aux shunts extrahépatiques, sont souvent plus difficiles à isoler et à atténuer chirurgicalement en raison de leur localisation dans le parenchyme hépatique.
Les SPS Acquis Multiples sont le plus souvent observés près du rein et à l'intérieur du mésentère intestinal, mais peuvent survenir n'importe où dans l'abdomen.
V- Méthodes d'occlusion chirurgicale
Toutes les techniques par laparotomie ou laparoscopie nécessitent une dissection du fascia péri-vasculaire. Une dissection minimale autour du shunt offre une certaine stabilité au dispositif d'occlusion.
1. Ligature par Suture
Une occlusion complète ou partielle du SPS peut être réalisée à l’aide de fil de soie ou du polypropylène. Cependant, la majorité des chiens (50 à 80 %) et des chats (71 %) ne tolèrent pas une occlusion complète aiguë en raison du risque de HP [1]. Une atténuation complète en deux interventions a été réalisée chez 81,8 % des chiens [1].
2. Constricteur améroïde (CA)
Il est constitué d'un anneau interne de caséine entouré d'une gaine en titane ou en plastique. L'anneau de caséine se distend lentement après l'implantation (par absorption du liquide corporel), ce qui entraîne une occlusion progressive du shunt dans les 2 à 5 semaines suivant l’implantation, due à la compression mais aussi à la fibrose et à la formation de thromboses. Le choix de la taille de l’anneau (3,5 à 9 mm) est basé sur le diamètre du shunt. Une étude expérimentale a révélé que le degré d'occlusion du shunt par les CA est variable et imprévisible, que l'occlusion complète du shunt dépend généralement de la réaction des tissus mous et de la thrombose associée au CA, et que les CA de plus grand diamètre présentent un risque d'occlusion incomplète [2].
3. Bande de Cellophane (BC)
Le cellophane provoque une réaction inflammatoire similaire à celle d'un corps étranger chronique, entraînant la formation de thrombus et une atténuation progressive. La BC est découpée en bandes d'environ 1 x 10 cm, pliée longitudinalement en 3 ou 4 puis enroulée autour du shunt. Ces extrémités sont fixées ensembles avec 4 clips hémostatiques en titane ou en polymère non résorbable. Les clips en polymère ont l’avantage d’éviter les artéfacts sur le scanner.
Les BC les plus utilisées en France sont d’origine non médicales. Une étude a déterminé que 4 BC disponibles commercialement et étiquetées comme du cellophane présentaient une grande variabilité dans leurs propriétés structurales. Une seule était cohérente avec un matériau à base de cellulose, tandis que les autres étaient en polyoléfine ou en en polyester. L'immersion dans une solution saline et les méthodes de stérilisation peuvent réduire la résistance des bandes de cellophane. Leurs différences de composition moléculaire, l'absence de normalisation de leur pose, la stérilisation des matériaux et la réponse inflammatoire naturelle du patient suscitent des inquiétudes quant à la reproductibilité et à la fiabilité de leur utilisation pour l'atténuation des shunts, ce qui pourrait entraîner une efficacité chirurgicale aléatoire. Néanmoins, la plupart des études, même avec l’utilisation de polyoléfine, donne des résultats à long terme similaires à ceux des CA [3,4]. Il reste à déterminer si une atténuation complète est réalisable chez les patients présentant des SPS importants.
4. Les occludeurs hydrauliques (OH)
Les OH sont des dispositifs médicaux comportant un ballonnet gonflable en silicone et en polyester placé autour du vaisseau, relié à un système de gonflage (chambre d’injection sous cutanée). Les OH permettent une occlusion complète et progressive du shunt, adaptée aux besoins de chaque patient, par injection de sérum physiologique à travers la chambre pour gonfler le ballonnet toutes les 2 semaines. La fermeture du shunt se produit généralement en 6 à 8 semaines et ne dépend pas de la formation de tissu fibreux. Le risque principal est la rupture du ballonnet, annulant l’occlusion du shunt : cela confirme l'impression que le OH ne peut pas induire une inflammation et une fermeture à long terme du shunt sans le ballonnet.
5. Dispositif en acide polyacrylique-silicone (APS)
Pas encore disponible commercialement, il semble néanmoins prometteur. Sa couche interne est constituée de silicone et d’acide polyacrylique et la couche externe d’un polymère plastique. Il ferme le shunt via une occlusion physique progressive sur une période de 6 à 8 semaines sans dépendre de l'inflammation, de la fibrose ou de la thrombose. Il a été montré qu'il gonfle de manière fiable sur 4 à 6 semaines in vitro. Les composants radiotransparents permettent une imagerie postopératoire par angioscanner sans artefact. Ses avantages résident dans la répétabilité des délais de fermeture et la facilité d'application.
6. Techniques mini-invasives
Elles incluent laparoscopie et radiologie interventionnelle.
La technique par laparoscopie est analogue à celle décrite pour la BC lors de laparotomie. L'atténuation du SPS par laparoscopie peut être réalisée chez les chiens, en particulier pour un SPS extrahépatique situé dans le foramen épiploïque (taux de succès : 85,7%). Une conversion en laparotomie s’avère nécessaire dans environ 30% des cas en particulier sur les shunts en dehors du foramen épiploïque.
L'embolisation percutanée par des coils, sous fluoroscopie, peut être utilisée pour atténuer les SPS intra-et extra- hépatiques [5]. Seule une petite incision est pratiquée pour permettre l'accès aux vaisseaux sanguins (veine fémorale ou jugulaire). Les coils sont des bandes métalliques avec des fibres de polyester thrombogènes. Ils provoquent d’abord une occlusion mécanique puis la formation d'un thrombus - l'occlusion se produit en 1 à 2 mois [5]. Les coils sont déployés dans le SPS jusqu'à ce qu'ils occupent plus de 75 % du diamètre du shunt [5]. Des coils supplémentaires peuvent être ajoutées ultérieurement si les signes cliniques persistent ou si le patient nécessite toujours un traitement médical. La migration des coils vers le cœur ou les poumons est rapportée à cause des débits élevés ou du grand diamètre du shunt. La mise en place d'un stent à l'entrée du shunt dans la veine cave caudale ou la veine hépatique empêche leur migration [5].
VI- Récidive / persistance des signes cliniques
Les raisons possibles sont une occlusion incomplète du SPS avec un flux persistant, un positionnement ou un emplacement sous-optimal du dispositif, ou le développement de SPS acquis. Un flux persistant dans le SPS a été décrit chez 21 % des chiens traités avec un CA, chez 47 % des chiens traités avec BC, chez 33 % avec l’APS, et chez 57 % avec un CA ; 20 % après BC chez les chats [1,2,3,4,5]. Une étude récente basée sur une échographie postopératoire, un angioscanner ou une laparotomie exploratrice a identifié un taux plus élevé de shunt continu chez les chiens traités avec BC par rapport au CA [2]. Un flux résiduel à travers le SPS intra-hépatique a été décrit chez 50 % des cas après la pose de BC. Malgré l'échec de l'atténuation complète, la majorité de ces cas ne présentaient pas de signes cliniques. Les propriétaires des chiens présentant un flux résiduel n'ont signalé aucun impact sur l'état clinique dans plus de 92 % des cas [4].
Le traitement recommandé dépend de la présence de signes cliniques et de la cause du shunt résiduel. Si un flux sanguin est présent dans le SP avec signes cliniques décrits, ou si un SPS supplémentaire est identifié et a été omis lors de la première intervention, une seconde est recommandée.
Bibliographie
- Tivers et coll.. Intrahepatic Congenital Portosystemic Shunts in Dogs: Short- and Long-Term Outcome of Suture Attenuation. J. Small Anim. Pract. 2018 ; 59, 201–210
- Traverson M et coll. Comparative outcomes between ameroid ring constrictor and cellophane banding for treatment of single congenital extrahepatic portosystemic shunts in 49 dogs (1998-2012). Vet Surg. 2018; 47:179-187.
- Matiasovic et coll. Outcomes of Dogs Treated for Extrahepatic Congenital Portosystemic Shunts with Thin Film Banding or Ameroid Ring Constrictor. Vet Surg. 2020; 49, 160–171
- Otomo A et coll. Long-Term Clinical Outcomes of Dogs with Single Congenital Extrahepatic Portosystemic Shunts Attenuated with Thin Film Banding or Ameroid Ring Constrictors. Vet Surg. 2020; 49, 436–444
- Case, J.B. et coll. Outcomes of Cellophane Banding or Percutaneous Transvenous Coil Embolization of Canine Intrahepatic Portosystemic Shunts. Vet Surg. 2018; 47, 59–66.
> Shunt porto-systémique : suivi médical postopératoire
Nantes
I- Complications immédiates
Après l’intervention, les animaux doivent rester hospitalisés en moyenne pendant 48h afin de contrôler la douleur et surveiller la survenue d’éventuelle complication. En période postopératoire immédiate, la survenue d’une hypoglycémie est possible, surtout dans les races miniatures, et peut faire l’objet d’une correction par le biais d’une perfusion de glucose 5%. Si la glycémie baisse en dessous de 60 mg/dL, une injection dexaméthasone (0,02 à 0,05 mg/kg IV) est indiquée par certains auteurs. La glycémie devrait se stabiliser dès que l’alimentation entérale aura repris (dès que l’animal est capable d’avaler).
Des crises convulsives peuvent survenir jusqu'à 96 heures après l'intervention chirurgicale chez 2 à 18 % des animaux. La cause de ces crises retardée demeure inconnue mais on suspecte la levée de l’inhibition de foyers épileptogènes par la diminution des toxines benzodiazépine-like. Si la glycémie est bien normale, l’administration de lévétiracétam est indiquée. En cas de status epilepticus réfractaire, une perfusion continue de propofol pendant 12 à 24 heures dans une unité de soins intensifs. L’administration de mannitol est envisagée en cas de suspicion d'œdème cérébral. Le phénobarbital IV est débuté pendant que l'animal reçoit la perfusion de propofol afin d’assurer le relais.
Après la ligature du shunt portosystémique, la surveillance vise également à déceler des signes d'hypertension portale (choc hypovolémique, hypothermie progressive, douleurs abdominales sévères, méléna, distension abdominale). Si ces signes apparaissent, un contrôle échographique immédiat est nécessaire pour rechercher une fermeture brutale du shunt en lien avec le dispositif ou la formation d’un thrombus. Selon la gravité des signes cliniques, l'animal peut nécessiter une nouvelle intervention chirurgicale pour retirer le dispositif de fermeture. Une hypertension portale légère à modérée s’exprime en général plus tardivement (2 à 4 semaines) et est généralement mise en évidence par une distension abdominale due à une accumulation de liquide (transsudat modifié à taux protéique <25 g/L). La vidange n’est pas utile sauf si l'animal a des difficultés à respirer. Dans ce dernier cas de figure, l'animal est traité avec des diurétiques (par exemple du furosémide).
II- Suivi à moyen terme
Le lactulose est poursuivi pendant au moins 2 à 4 semaines, en fonction des signes cliniques et de la gravité de la maladie. La quantité de protéines déterminée en période préopératoire est maintenue pendant plusieurs semaines et adaptée selon l’évolution clinique et biologique (albumine et glycémie en particulier). L’intérêt du suivi des acides biliaires sériques est minime car 75% des animaux conservent des valeurs élevées 12-18 mois après l’intervention. Si des signes cliniques ou une hypoalbunémie persiste 6 mois après l'intervention chirurgicale, un examen d’imagerie (échographie, angioscanner) est nécessaire pour évaluer le flux résiduel dans le shunt et s’interroger sur l’intérêt d’une nouvelle intervention. Cette dernière peut être envisagée en cas de flux résiduel suffisamment conséquent pour expliquer la persistance des signes. En revanche, si des signes d’hypertension portale sont identifiés (nouveaux shunts), une hypoplasie du réseau porte est probable et contre-indique toute nouvelle intervention.
