> Lésion osseuse agressive chez le jeune chien : ostéomyélite versus tumeur osseuse ?
Lyon France
I- Introduction
La détection précoce des lésions osseuses agressives chez le jeune chien est essentielle pour un traitement rapide et efficace. En imagerie médicale vétérinaire, les deux principales causes de lésions osseuses agressives chez le jeune chien sont l'ostéomyélite et les tumeurs osseuses. Cependant, différencier ces deux entités peut être un défi, car leurs présentations radiologiques se chevauchent.
II- Les lésions osseuses agressives à la radiographie : comment les reconnaître ?
Le caractère agressif d’une lésion osseuse est déterminé par trois critères : la destruction de la corticale osseuse, une réaction périostée irrégulière et/ou une zone de transition longue. La présence d’un seul de ces trois critères suffit pour affirmer le caractère agressif de la lésion.
Le caractère primitivement lytique ou sclérotique d’une lésion osseuse n’est pas un critère d’agressivité : contrairement aux idées reçues, une lésion majoritairement ostéoproductive peut être agressive, et une lésion impressionnante à première vue peut se révéler bénigne.
1. Ostéolyse et destruction du cortex
Lors de processus osseux agressif, la corticale osseuse est souvent atteinte par une ostéolyse plus ou moins étendue, pouvant conduire à sa disparition complète.
Le type d’ostéolyse (en carte de géographie, à l’emporte-pièce, punctiforme) doit par ailleurs être utilisé pour décrire la lésion mais n’est pas un critère discriminant d’agressivité. En effet, même s’il est couramment admis que la lyse en carte de géographie (large plage de lyse osseuse à contours nets) correspond à un processus non agressif, dans certains cas ce type de lyse accompagne une lésion agressive. En revanche, une lyse osseuse punctiforme (très petites plages multiples de lyse, mal délimitées) est presque toujours associée à une lésion osseuse agressive.
2. Réaction périostée
La réaction périostée est une production osseuse siégeant dans le périoste. Il en existe de nombreux types (Figure 1).
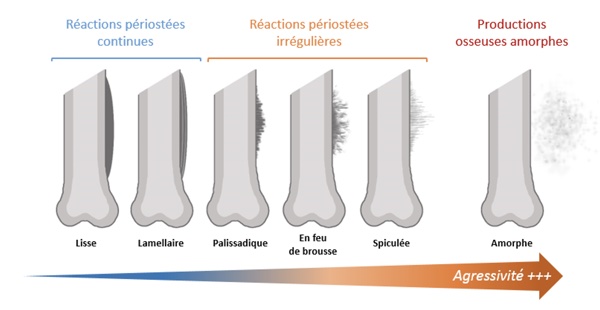
Figure 1
Les réactions périostées continues (à bords lisses) sont évocatrices de processus bénins à développement lent, comme dans les cas de formation d’un cal fracturaire. Cependant, l’observation de ce type de réaction périostée n’exclut pas un processus malin ou infectieux si l’un des deux autres critères d’agressivité est présent.
3. Zone de transition
La zone de transition est la région permettant de faire la distinction entre l’os sain et l’os lésé. Lors de lésion osseuse agressive, les remaniements osseux sont rapides et l’os n’a pas la capacité de contenir la lésion : la zone de transition est longue. Lors de processus lent l’os a le temps de se remodeler et la zone de transition est courte. En pratique, une lésion dont on dessine facilement les contours présente une zone de transition courte.
4. Autres critères
Les lésions osseuses agressives sont par ailleurs souvent associées à la présence d’une tuméfaction des tissus mous adjacents. La présence de gaz est notamment importante à rechercher car pouvant évoquer une plaie pénétrante et donc orienter vers une ostéomyélite.
Enfin, la vitesse d’évolution de la lésion est associée à son agressivité. Les lésions bénignes ne présentent généralement pas d’évolution significative lors de contrôle radiographique à 10-14 jours.
III- C’est agressif, que dois-je regarder d’autre ?
Puisque les processus infectieux et tumoraux ont le même aspect radiographique, nous devons utiliser d’autres critères pour les discriminer.
1. Bien localiser la lésion
La distribution des lésions sur le squelette doit être examinée. Certaines affections osseuses ont un tropisme particulier pour une région d’un os en particulier. En corrélant la localisation des lésions avec les critères épidémiologiques, le diagnostic différentiel peut être affiné (Figure 2).
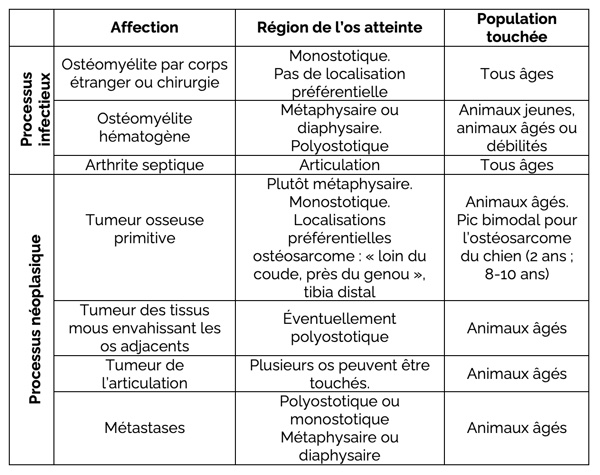
Figure 2
2. Focus sur les lésions monostotiques
a) Les tumeurs osseuses
L’ostéosarcome est la tumeur osseuse primaire monostotique la plus fréquente, représentant environ 80 % des tumeurs primitives osseuses chez le chien de grande race. Tous les os peuvent être atteints mais 75% des ostéosarcomes concernent les os longs du squelette appendiculaire. La lésion est classiquement située en région métaphysaire. Les sites de prédilection sont classiquement dits « loin du coude, près du genou » :
- région proximale de l’humérus ;
- région distale du radius et de l’ulna ;
- région distale du fémur ;
- région proximale et distale du radius.
Ces tumeurs sont plus fréquemment rencontrées chez les chiens de grande race ou de race géante. Deux pics d’âge sont classiquement rencontrés chez le chien, le premier chez le jeune adulte et le second chez l’animal âgé.
Les ostéosarcomes débutent en région métaphysaire puis progressent en direction de la diaphyse et de l'épiphyse.
Les ostéosarcomes ne traversent pas les articulations. En règle générale, les tumeurs primitives osseuses atteignent un seul segment osseux. Quelques exceptions à cette règle peuvent être rencontrées, en particulier pour le radius et l'ulna, et pour le tibia et la fibula. Cependant, lorsqu'un deuxième os est touché, la lésion se manifeste le plus souvent par une réaction périostée de voisinage, et la lésion reste centrée sur la métaphyse de l'os principalement atteint.
b) Les ostéomyélites
Les principales causes d’ostéomyélite sont : plaie accidentelle, morsure, fracture ouverte, pénétration d’un corps étranger, pose d’implants orthopédiques. Ceci a pour conséquence que les ostéomyélites sont généralement localisées, et peuvent affecter n’importe quelle partie du squelette et n’importe quelle partie de l’os.
A la radiographie, les lésions associées à une ostéomyélite sont des lésions typiquement ostéoproductives. La production osseuse est liée à une réaction périostée ou endostée à l’agression que représente l’infection. En phase active de l’infection, cette réaction est irrégulière, mal définie, floue. Lors de développement d’une infection sur une fracture, la réaction osseuse est parfois difficile à distinguer du cal osseux, en particulier chez le jeune chez qui le cal osseux peut être exubérant. En phase chronique ou lors de guérison, elle devient plus organisée, lisse et régulière.
c) Lésions vertébrales
Lors d’infection d’une vertèbre on parle de spondylite. Le plus souvent l’origine est également une infection de proximité, en particulier en lien avec la migration d’un corps étranger végétal inhalé qui termine sa course en regard des piliers du diaphragme, situés ventralement à L3 et L4.
On note alors une sclérose d’un ou plusieurs corps vertébraux selon la localisation de l’infection, mais avec préservation de l’espace intervertébral. Une ostéolyse est parfois visible, de même qu’une réaction périostée.
Une spondylite ne doit pas être confondue avec des métastases vertébrales, souvent rencontrées lors de tumeurs primitives uro-génitales. Les métastases sont à l’origine de productions osseuses très irrégulières, extensives et d’une ostéolyse plus discrète. Elles affectent les vertèbres lombaires caudales en priorité.
3. Focus sur les lésions polyostotiques
a) Les tumeurs osseuses
Les processus néoplasiques polyostotiques sont de 3 types : les métastases, les tumeurs articulaires, les tumeurs médullaires :
- Les métastases
Les métastases osseuses sont moins fréquentes chez le chat et le chien que chez l'homme. Les tumeurs les plus souvent incriminées sont les carcinomes mammaires, les carcinomes à cellules transitionnelles (rein, vessie, urètre), les adénocarcinomes thyroïdiens et pulmonaires et les ostéosarcomes.
Tous les os du squelette peuvent être atteints ; cependant les côtes, les vertèbres, le fémur et l'humérus représentent environ 80 % des lésions.
- Les tumeurs articulaires
Ces tumeurs sont centrées sur une articulation et de type mésenchymateux (fibrosarcome, sarcome histiocytaire, …). Elles se développent à partir de la capsule articulaire et se caractérisent pas la forte tuméfaction des tissus mous qu’elles engendrent. On recherchera par conséquent une masse centrée sur l’articulation. Une ostéolyse sous-chondrale à l’emporte-pièce est notée, détruisant l’os sous-chondral. Une ostéolyse mieux délimitée par compression sur l’os, délimitée par un halo sclérotique, est également parfois notée.
- Les tumeurs médullaires
Il s’agit de tumeurs à cellules rondes de type lymphome, myélome multiple ou plasmocytome. Leur site de prédilection est différent de celui des ostéosarcomes et sarcomes articulaires puisque ces tumeurs se développent dans les os riches en moelle : vertèbres, côtes, bassin, fémur, humérus.
Ces tumeurs sont trompeuses car à l’origine de lésion d’aspect plutôt bénin. En effet on observera des lésions dites en géodes ou à l’emporte-pièce dans la cavité médullaire des os affectés. Les processus épineux et intervertébraux dorsaux doivent particulièrement être scrutés sur une radiographie de profil, ces derniers étant dénués de superposition.
b) Les ostéomyélites
Les ostéomyélites hématogènes touchant les os longs sont très rares chez le chat et le chien. Le foyer infectieux primitif est le plus souvent pulmonaire. Ces lésions se retrouvent sur les zones les plus vascularisées de l’os : l’épiphyse et la métaphyse, et en particulier chez des animaux jeunes.
La tuberculose, bien que rare, est parfois rencontré chez le chat et à l’origine de lésions lytiques mal délimitées sur les os longs, le tarse et le carpe. Des lésions abdominales et thoraciques lui sont généralement associées.
c) Les discospondylites
Il s’agit d’une infection d’un disque intervertébral et des plateaux vertébraux adjacents. Leur origine est hématogène, issues d’un foyer infectieux le plus souvent cutané ou uro-génital. Il est à noter que des discospondylites aspergillaires sont possibles, en particulier chez le Berger allemand. On notera également que la parvovirose canine est un facteur prédisposant aux discospondylites, ces dernières apparaissant 2 à 3 semaines après résolution de la forme digestive.
L’apparition des signes radiographiques est tardive, généralement 3 à 4 semaines après le début des signes cliniques. En effet l’infection touche initialement les tissus mous adjacents au disque et le disque lui-même, non visible en dehors d’un possible élargissement subtil de l’espace intervertébral. En phase chronique, la destruction du disque et des plateaux vertébraux conduit à un collapsus de l’espace intervertébral et à une ostéolyse irrégulière des plateaux. Une subluxation est parfois présente entre les deux vertèbres atteintes.
IV- Conclusion
La distinction entre l'ostéomyélite et les tumeurs osseuses chez le jeune chien en imagerie médicale est cruciale pour planifier un traitement approprié. Les aspects d'imagerie, associés à une évaluation anamnestico-clinique minutieuse, peuvent aider à différencier ces deux entités. Le diagnostic définitif nécessitera cependant la réalisation de prélèvements pour culture bactérienne (voire fongique) et une analyse cytologique (ou histologique).
> Masses médiastinales crâniales : lymphome vs thymome ?
Villeneuve D'ascq France
I- Introduction
Les diagnostics différentiels des masses médiastinales comprennent les lymphomes, le thymome, les tumeurs thyroïdiennes ectopiques, les kystes branchiaux et, rarement, les sarcomes et les néoplasmes métastatiques.
Les deux tumeurs médiastinales les plus fréquemment rencontrées chez les chiens et les chats sont le lymphome et le thymome. Leur différenciation est très importante étant donné que cela change complètement le traitement et le pronostic.
II- Qu'est-ce que le thymome ?
Le thymome est la deuxième tumeur la plus fréquente dans le médiastin des chiens et des chats. L'âge moyen au moment du diagnostic est de 9 ans chez le chien et de 10 ans chez le chat. Il s'agit d'un tumeur maligne peu fréquente qui provient des cellules épithéliales du thymus, avec un faible taux de métastases et qui a tendance à évoluer lentement. Il se présente comme une masse bien encapsulée ou, parfois, peut présenter des caractéristiques infiltrantes englobant, par exemple, de gros vaisseaux sanguins tels que la veine cave crâniale. Des métastases aux poumons, aux ganglions lymphatiques régionaux, au diaphragme, à la rate et au foie sont également rapportées dans la littérature, mais elles sont rares. Les animaux atteints présentent des signes cliniques dus à la compression de la masse sur les organes adjacents (régurgitations, vomissements, toux, tachypnée ou dyspnée et léthargie). Plus rarement, les patients peuvent présenter le syndrome de la veine cave crâniale, caractérisé par un œdème des membres antérieurs, de la tête et du cou.
Les syndromes paranéoplasiques sont fréquents chez les chiens et les chats et peuvent survenir dans 67 % des cas de thymome. Les plus courants sont la myasthénia gravis chez le chien et la dermatite exfoliative chez le chat. Ces dernières, en particulier, sont considérées comme des syndromes paranéoplasiques qui doivent renforcer notre suspicion d'un possible thymome lorsqu'elles sont observées chez les patients. Les syndromes paranéoplasiques peuvent survenir au moment du diagnostic, plus tard ou même après l'exérèse de la tumeur. D'autres syndromes paranéoplasiques, moins fréquents, associés au thymome sont un érythème polymorphe, une hypercalcémie, lune ymphocytose à cellules T, de l'anémie, une myocardite et une polymyosite.
III- Qu'est-ce que le lymphome médiastinal ?
Parmi les différentes localisations possibles du lymphome chez le chien et le chat, on trouve la forme médiastinale. Chez le chien, le lymphome médiastinal est la troisième forme de lymphome la plus fréquente, précédée par les formes multicentriques et gastro-intestinales. Les chats infectés par la FeLV ont un risque environ 60 fois plus élevé de développer un lymphome que les chats non infectés. Le lymphome médiastinal est la forme la plus courante de lymphome associé au FeLV, en particulier avant l'existence des vaccins contre le FeLV. La plupart des chats présentant un lymphome médiastinal sont jeunes (âge médian, 2-4 ans), FeLV positifs, et avec un immunophénotype à cellules T.
Chez les chats, dans les races siamoises/orientales, il semble y avoir une prédisposition pour la forme médiastinale qui n'est pas associée au FeLV et qui représente une population plus jeune (médiane de 2 ans), mais semble être moins agressive, plus sensible à la chimiothérapie que les formes associées au FeLV. Cette forme se caractérise par une augmentation des noeuds lymphatiques médiastinaux crâniaux, du thymus ou des deux. Les symptômes peuvent être très similaires à ceux des patients atteints de thymome, notamment faiblesse, anorexie, détresse respiratoire, polyurie et polydyspie en cas d'hypercalcémie et perte de poids. En outre, les chiens atteints de lymphome médiastinal peuvent présenter le syndrome de la veine cave crâniale, comme dans le cas du thymome. L'hypercalcémie est rapportée chez 10 à 40 % des chiens atteints de lymphome et est plus fréquente avec la forme médiastinale (42 % des cas). La forme médiastinale chez le chien est le plus souvent associée à un phénotype de cellules T.
IV- Quels sont les examens complémentaires à effectuer ?
En cas de suspicion de masse médiastinale, la procédure recommandée pour établir un diagnostic et définir le traitement le plus approprié repose sur les éléments suivants :
- examen hémochromocytométrique : cet examen peut révéler la présence d'une anémie et d'une thrombocytopénie, probablement d'origine immunitaire. Une neutrophilie et une lymphocytose peuvent également être détectées ;
- profil biochimique complet et mesure des électrolytes : une hypercalcémie est rapportée chez 34 % des chiens atteints de thymome, mais elle est également fréquemment observée chez les chats et les chiens atteints de lymphome ;
- radiographies du thorax : elles permettent d'évaluer la présence d'une masse médiastinale crâniale et de mettre en évidence un éventuel épanchement pleural et/ou une dislocation de la silhouette cardiaque. Elles ne permettent pas de différencier un lymphome d'un thymome ;
- échographie abdominale avec cytologie de la rate et du foie : cette procédure permet d'évaluer une éventuelle infiltration des ganglions lymphatiques abdominaux, de la rate et du foie, s'il s'agit d'un lymphome médiastinal et non d'un thymome;
- ponction échoguidée de la masse médiastinale. Les corpuscules de Hassal sont caractéristiques du thymome et peuvent être utiles pour confirmer le diagnostic cytologique de thymome. Les caractéristiques cytologiques du thymome peuvent être distinctes de celles du lymphome dans de nombreux cas, mais le diagnostic peut être difficile à établir en raison de la prépondérance des petits lymphocytes dans le thymome. Des mastocytes peuvent également être observés dans près de 50 % des aspirations de thymomes. Grâce à la ponction de la masse, la cytométrie en flux peut également être réalisée. L'examen cytologique et la cytométrie de flux sont utiles pour confirmer le diagnostic de thymome et exclure ainsi un lymphome médiastinal ou thymique. En effet, le thymome présente une expression simultanée des récepteurs des lymphocytes T, CD4 (lymphocytes T-helper) et CD8 (lymphocytes T cytotoxiques), notamment chez le chien. Contrairement aux chiens, la prévalence élevée des lymphomes CD4+CD8+ chez les chats rend difficile la différenciation des lymphomes et des thymomes à l'aide de la seule cytométrie de flux. Elle peut apporter des informations intéressantes pour affiner le diagnostic dans certains cas, mais le test de clonalité PARR et l'histopathologie restent obligatoires pour établir la différence en cas d'expression de cellules lymphoïdes doublement positives CD4+CD8+ ;
- si l'examen cytologique n'est pas concluant, une biopsie avec examen histologique par tru-cut peut être réalisée. Scanner du corps entier : cette technique avancée nous permet non seulement d'étudier l'étendue de la maladie avec plus de précision, mais aussi d'évaluer la possibilité de réaliser ou non une exérèse chirurgicale et de planifier la chirurgie dans le cas d'un thymome non invasif.
V- Quel est le traitement du thymome et quel est le pronostic ?
Le traitement de choix est une exérèse chirurgicale de la masse, lorsque cela est possible. Non seulement ce traitement peut être curatif, mais il peut aussi faciliter la résolution d'éventuels syndromes paranéoplasiques. Dans ce cas, la durée de survie peut être longue. La durée médiane de survie des patients traités par chirurgie seule est de plus de 2 ans et de 5 ans pour les chiens et les chats, respectivement. Toutefois, si le patient n'est pas candidat à la chirurgie en raison de la présence d'un thymome invasif, la radiothérapie peut être une alternative viable. Des études récentes montrent des durées de survie de 8 mois pour les chiens et de près de 2 ans pour les chats. La radiothérapie peut également être envisagée en cas de récidive ou comme traitement adjuvant après la chirurgie pour les thymomes particulièrement invasifs et agressifs qui n'ont pas été complètement retirés. Enfin, le rôle de la chimiothérapie dans la prise en charge des thymomes n'a pas été défini. La littérature fait état d'une réponse à la doxorubicine (DOX), à la vincristine et à la L-asparginase.
VI- Quel est le traitement du lymphome médiastinal et quel est le pronostic ?
Le traitement de choix des lymphomes de haut grade chez les chiens et les chats est la chimiothérapie cytotoxique. Le pronostic est malheureusement moins favorable que pour le thymome et le traitement n'est pas curatif, bien que des rémissions complètes puissent être obtenues.
Les chats atteints de lymphome médiastinal traités avec des protocoles COP (vincristine, cyclophosphamide et prednisolone) ou CHOP (vincristine, doxorubicine, cyclophosphamide et prednisolone montrent une réponse globale de 95%, avec une durée de survie médiane de 1 an. En cas de rémission complète, la survie médiane rapportée dans la littérature est d’environ 2.5 ans. En revanche, le lymphome médiastinal chez les jeunes chats FeLV-positifs est généralement associé à un mauvais pronostic et des durées médianes de survie d'environ 2 à 3 mois sont attendues après un traitement basé sur des protocoles CHOP ou COP. Toutefois, une étude récente a cependant montré des durées médianes de survie de presque un an dans ce type de population, traitée avec le protocole COP.
Chez les chiens atteints de lymphome médiastinal de haut grade, le traitement par un protocole CHOP permet d'obtenir une durée de survie médiane d'environ 6 mois. Il a été rapporté que la chimiothérapie améliore significativement le pronostic. L'absence d'épanchement pleural au moment du diagnostic est associée à une durée de survie plus longue.
Des études plus récentes ont évalué la réponse et le pronostic chez des chiens atteints de lymphome de type T traités avec le protocole LOPP (lomustine, vincristine, procarbazine et prednisolone), avec une survie médiane supérieure à un an, mais ces études ont inclus des patients présentant différentes localisations et pas seulement la forme médiastinale. Cependant, aujourd'hui, le protocole LOPP est une alternative intéressante dans les cas de lymphome de type T de haut grade chez le chien.
VII- Conclusion
Les différences de traitement et de pronostic dans le cas du thymome ou du lymphome médiastinal soulignent à quel point il est important de procéder à des examens complémentaires dans le cas de chiens ou de chats présentant des masses médiastinales, bien qu'ils puissent présenter des symptômes graves.
Bibliographie
- Withrow and MacEwen's Small Animal Clinical Oncology, 6th edition (2020). Chapitres 33 and 34.
- Bernardi S et coll. Flow Cytometric Analysis of Mediastinal Masses in Cats: A Retrospective Study. Front Vet Sci. 2020 Aug 7;7:444.
- Martano M et coll. Canine Epithelial Thymic Tumors: Outcome in 28 Dogs Treated by Surgery. Animals (Basel). 2021 Dec 2;11(12):3444.
- Sunpongsri S et coll. Effectiveness and Adverse Events of Cyclophosphamide, Vincristine, and Prednisolone Chemotherapy in Feline Mediastinal Lymphoma Naturally Infected with Feline Leukemia Virus. Animals (Basel). 2022 Mar 31;12(7):900.
- Moore EL et coll. Patient characteristics, prognostic factors and outcome of dogs with high-grade primary mediastinal lymphoma. Vet Comp Oncol. 2018 Mar;16(1):E45-E51.
> Modifications hématologiques lors de leucémie aiguë ou de myélodysplasie
Saint Laurent Du Var France
I- Introduction
La leucémie aiguë et la myélodysplasie sont deux processus pathologiques touchant le tissu hématopoïétique et la production des cellules sanguines produites dans la moelle (globules rouges, granulocytes, monocytes, et plaquettes).
Plus précisément, la leucémie aiguë correspond à une prolifération maligne de cellules sanguines qui se caractérise par l’accumulation dans la moelle et, très souvent, dans le sang de cellules immatures. On distingue en fait 2 grands types de leucémie : les leucémies aiguës lymphoblastiques (LAL) qui correspondent à une prolifération médullaire clonale de progéniteurs lymphoïdes et les leucémies aiguës myéloïdes (LAM) qui correspondent à une prolifération médullaire clonale de progéniteurs des lignées rouge, granulocytaire, monocytaire, ou plaquettaires. Cette prolifération se réalise aux dépens des autres cellules précurseurs sanguines, entrainant généralement un « étouffement » (myélophtisie) des lignées sanguines non néoplasiques. On observe ainsi de manière concomitante un syndrome tumoral se traduisant par un envahissement médullaire et généralement sanguin par des cellules tumorales blastiques et un syndrome d’insuffisance médullaire qui se traduit par une baisse, voire disparition, des lignées sanguines normales dans la moelle et le sang (anémie non régénérative, neutropénie, thrombocytopénie).
La myélodysplasie regroupe les syndromes myélodysplasiques et les dysmyélopoïèses secondaires.
Les syndromes myélodysplasiques correspondent à un groupe hétérogène de maladies caractérisées par une prolifération clonale de cellules souches hématopoïétiques se traduisant par une hématopoïèse inefficace et dysplasique. Les syndromes myélodysplasiques se traduisent par, pour le compartiment sanguin, par une ou plusieurs cytopénies avec présence de cellules dysplasiques, et, pour le compartiment médullaire, par une moelle normo- ou hypercellulaire avec présence de cellules dysplasiques.
Les dysmyélopoïèses secondaires correspondent à atteintes non clonales du tissu hématopoïétique se traduisant par des anomalies sanguines et médullaires similaires à celles observées lors de syndrome myélodypalsiques. Ces dysmyélopoïèses peuvent être secondaires notamment à des anémies ou thrombocytopénies à médiation immune, des processus néoplasiques (lymphome notamment), des intoxications (aux métaux lourds) ou des médicaments azathioprine, cytosine-arabinoside, vincristine, cyclophosphamide, phénobarbital, œstrogène, chloramphénicol, etc.
Les leucémies aiguës et la myélodysplasie étant secondaires à une atteinte médullaire, certaines anomalies notées à l’analyse hématologique ainsi qu’au myélogramme vont être fortement évocatrice, voire diagnostiques de ces affections. Des colorations spéciales, des tests d’immunophénotypage, et de biologie moléculaire (Test de clonalité,/PARR) peuvent permettre de compléter le diagnostic.
II- Examen hématologique
1. Numération-formule
a) Leucémie aiguë
En raison du syndrome tumoral et du passage dans le secteur circulant des cellules néoplasiques, les leucémies aiguës s’accompagnent le plus souvent d’une leucocytose souvent très marquée (plus de 50 0000 à 100 000 cellules/uL). Beaucoup plus rarement, on observe une leucopénie (leucémie aleucémique) lorsque les cellules néoplasiques restent cantonner à la moelle.
La leucémie aiguë se traduit parallèlement par un syndrome d’insuffisance médullaire par étouffement des cellules précurseurs sanguines non néoplasiques ce qui se traduit généralement à la numération-formule par une neutropénie, une anémie non régénérative et une thrombocytopénie. Les granulocytes ayant la demi-vie la plus courte (48 h) comparée aux plaquettes (14 jours) et aux globules rouges (60-90jours). La neutropénie est généralement la cytopénie la première à apparaître (notons néanmoins qu’au moment du diagnostic de leucémie aiguë, l’anémie et la thrombocytopénie sont également généralement présentes). En raison de la présence de blastes circulants, les automates d’hématologie rendent souvent des résultats erronés avec notamment une surestimation du comptage de granulocytes neutrophiles et/ou des lymphocytes et/ou de monocytes ; les fragments cytoplasmiques des cellules néoplasiques peuvent par ailleurs être comptés comme des réticulocytes par les automates utilisant la cytométrie en flux.
b) Myélodysplasie
En raison de l’hématopoïèse inefficace et dysplasique, les syndromes myélodysplasiques et des dysmyélopoïèses secondaires se traduisent à la numération-formule par la présence d’une ou de plusieurs cytopénies. La présence d’une bicytopénie sans cytose majeure ou d’une pancytopénie (anémie non régénérative, leucopénie/neutropénie, et thrombocytopénie) est un signe d’appel fort vers une myélodysplasie.
Chez le chat principalement, la présence d’une macrocytose (globules rouges présentent un volume globulaire moyen supérieur à celui habituellement observé dans l’espèce) en présence d’une anémie non régénérative doit faire suspecter une dysérythropoïèse secondaire à un syndrome myélodysplasique ou une dysmyélopoïèse secondaire.
2. Frottis sanguin
L’examen du frottis sanguin est un élément majeur lors de suspicion de leucémie aiguë et/ou de myélodysplasie. Il permet en effet :
- de confirmer ou non les comptages rapportés par l’automate d’hématologie;
- de mettre en évidence la présence de cellules blastiques et de les caractériser cytomorphologiquement;
- de rechercher des cellules démontrant des anomalies morphologiques signe de changements dysplasiques..
a) Confirmer ou non les comptages rapportés par l’automate d’hématologie
Comme indiqué précédemment, la présence de cellules néoplasiques ou dysplasiques dans le sang perturbe les automates d’hématologie ce qui peut entrainer des erreurs de comptages. L’examen du frottis permettra ainsi de confirmer ou non les cytopénies ou les cytoses rapportées par l’automate par évaluation semi-quantitative des trois lignées sanguines ainsi que, par la recherche d’agrégats plaquettaires, de confirmer ou non le différentiel leucocytaire, et enfin de confirmer ou non la présence de réticulocytes (cf. supra).
Lors de dysérythropoïèse, on peut observer de nombreux globules rouges nucléés (forte érythroblastose) alors que l’anémie est non régénérative. Ces globules rouges nucléés vont être comptés par l’automate comme des leucocytes et ainsi entrainer une surestimation du comptage leucocytaire. L’examen du frottis permet de détecter la présence de ces globules rouges nucléée et d’évaluer leur proportion relative par rapport aux leucocytes pour éventuellement corriger le comptage leucocytaire.
b) Détecter des cellules néoplasiques et évaluer leurs caractéristiques cytomorphologiques
Les leucémies aiguës sont caractérisées par une prolifération clonale peu différenciées apparaissant sous forme de blastes : myéloblastes pour la lignée granulocytaire, monoblastes pour la lignée monocytaire, rubriblastes (ou proérythroblastes) pour la lignée rouge, mégacaryoblastes pour la lignée plaquettaire, et lymphoblastes pour la lignée lymphoïde.
L’examen du frottis sanguin permet dans un premier temps de mettre en évidence la présence de ces cellules blastiques et d’en évaluer la proportion par rapport aux leucocytes matures ; dans bien des cas, la population leucocytes est quasi totalement remplacée par ces cellules blastiques. Une fois ces cellules identifiées, l’examen des détails nucléaires et cytoplasmiques de ces cellules peut permettre de préciser l’histogenèse des cellules néoplasiques même si d’autres examens complémentaires (colorations spéciales, immunophénotypage) n sont généralement nécessaires pour établir avec plus de certitude l’origine des cellules.
c) Rechercher des cellules démontrant des anomalies morphologiques signe de changements dysplasiques.
Les myélodysplasies sont caractérisées par une maturation anormale d’une ou de plusieurs lignées sanguines. Cette maturation anormale a pour conséquence la production de cellules d’allure atypique présentant par exemple une asynchronie de maturation entre le cytoplasme et le noyau (principalement pour la lignée rouge), des globules rouges présentant des inclusions de fer (sidéroblastes), des granulocytes hypersegmentés, ou des plaquettes de taille anormale. Associés à la présence d’une ou plusieurs cytopénies, ces éléments sont fortement évocateurs d’une myélodysplasie.
III- Myélogramme
Le myélogramme est un examen de confirmation des hypothèses de leucémies aiguës et de myélodysplasies.
Pour les leucémies aiguës, il peut permettre de confirmer la suspicion d’envahissement médullaire de la moelle osseuse, notamment lorsque les cellules néoplasiques sont présentes en faible en faible quantité, voire absente de la circulation sanguine. Selon les auteurs et les publications, il est considéré qu’il faut que les cellules blastiques représentent plus de 20 % ou 30 % des cellules nucléées présentes dans la moelle. En pratique, ce pourcentage est généralement supérieur à 60-70 % au moment du diagnostic.
Le patron cytologique lors de myélodysplasie est variable selon le type de syndrome myélodypalsique et les lignées atteintes. La moelle apparaît néanmoins souvent normo- à hypercellulaire et caractérisée par une maturation incomplète et/ou ne respectant pas la pyramide de maturation pour une ou plusieurs lignées. Des cellules d’allure atypique sont également fréquemment observées (granulocytes neutrophiles non segmentés géants, mégacaryocytes nains, granulocytes neutrophiles hypersegmentés, globules rouges nucléés présentant une asynchronie de maturation entre le cytoplasme et le noyau, etc.).
IV- Autres tests
Lors de leucémie aiguë, l’examen cytomorphologique des cellules néoplasiques, même par des cytopathologistes, ne permet pas toujours de déterminer avec certitude leur histogenèse. Le recours à des immunophénotypages, généralement par cytométrie en flux sur le sang ou sur du matériel de ponction médullaire, est alors nécessaire.
L’immunphénotypage consiste à mettre en évidence ou pas la présence d’antigènes spécifiques des lignées cellulaires (lymphoïde, myéloïde, granulocytaire, plaquettaire, érythroïde, etc.).
Des colorations spéciales mettant en évidence des caractéristiques biochimiques spécifiques de certaines lignées cellulaires (présence ou non de myéloperoxydase par exemple) peuvent également être utilisées. Elles sont néanmoins en perte de vitesse depuis le développement de la cytométrie en flux.
Afin de confirmer le caractère clonal d’une prolifération lymphoïde, un test de clonalité ou PARR peut être réalisé. Il a néanmoins généralement peu d’intérêt dans le cadre des leucémies lymphoïdes aiguës, pour lesquelles le caractère néoplasique du processus est aisément établi par l’examen au microscope.
Bibliographie
- Harvey JW. Bone Marrow Examination. In Harvey J W. Veterinary Hematology a diagnostic guide and color atlas. Elsevier, 2012, Saint Louis, Missouri, pp 260–327
- Stokol T., Acute Myeloid Leukemia. In: Brooks MB, Harr KE, Seelig DM, Wardrop KJ, Weiss DJ,. Schalm’s Veterinary Hematology, 7th edition, Wiley BlackWell, 2022, Ames, Iowa, 557–569
- Vial, AK. Immunophenotyping. In: Brooks MB, Harr KE, Seelig DM, Wardrop KJ, Weiss DJ,. Schalm’s Veterinary Hematology, 7th edition, Wiley BlackWell, 2022, Ames, Iowa, 508–514
- Weiss DJ, Sellon RK Myelodysplastic Syndromes. In: Brooks MB, Harr KE, Seelig DM, Wardrop KJ, Weiss DJ,. Schalm’s Veterinary Hematology, 7th edition, Wiley BlackWell, 2022, Ames, Iowa, 548–556
> Réaction post-vaccinale : règle du 3-2-1
Villefontaine France
Les réactions vaccinales cutanées sont relativement courantes en pratique générale. En effet, le principe de la vaccination est de générer une réponse inflammatoire suffisante pour initier une réaction immunitaire vis-à-vis des anticorps vaccinaux. Si dans la majorité des cas, la réaction inflammatoire est non décelable à l’examen clinique, il est possible de l’observer parfois, sous la forme d’une panniculite. Il s’agit d’une inflammation localisée, intéressant principalement le tissu adipeux sous-cutané, se présentant sous la forme d’un nodule ou d’une masse. Ce type de lésion évolue favorablement, en règle générale, vers une disparition complète.
Dans de rares cas, la réaction inflammatoire post-vaccinale, qu’elle se présente ou non sous la forme d’une panniculite, peut conduire à la formation d’une tumeur mésenchymateuse maligne appartement à la famille des sarcomes sous-cutanés : un groupe hétérogène sur le plan histologique mais au comportement biologique homogène (agressivité locale marquée, potentiel métastatique modéré), dominé par les fibrosarcomes sous-cutanés.
Ainsi, en situation clinique, la distinction entre une panniculite, susceptible d’involuer spontanément, et un sarcome sous-cutané peut être difficile, alors que l’attitude à adopter est radicalement différente.
La « règle » du 3-2-1 est un moyen mnémotechnique résumant les principaux signaux d’alerte à identifier lors de la découverte d’un nodule ou d’une masse sous-cutanée sur le site d’une injection vaccinale. Le risque que le nodule ou la masse soit un sarcome est considéré comme important si la masse persiste plus de 3 mois après la vaccination, si elle mesure plus de 2 cm, ou si sa taille progresse en l’espace de 1 mois après la vaccination. La détection de l’un de ces éléments doit inciter à la réalisation d’un examen histologique de la lésion préférentiellement sur du matériel obtenu par biopsie incisionnelle (au punch ou à l’aide d’une aiguille à biopsie) de sorte à bénéficier d’un diagnostic histologique précis et ainsi, adapter la démarche clinique. S'il s'agit d'un sarcome, le diagnostic histologique permet de prescrire les examens nécessaires au bilan d’extension puis de définir une stratégie thérapeutique optimale et personnalisée [1–3].
Bibliographie
- Hartmann K, Day MJ, Thiry E, Lloret A, Frymus T, Addie D, et al. Feline injection-site sarcoma: ABCD guidelines on prevention and management. J Feline Med Surg. juill 2015;17(7):606-13.
- Vaccine-Associated Feline Sarcoma Task Force guidelines. Diagnosis and treatment of suspected sarcomas. J Am Vet Med Assoc. 15 juin 1999;214(12):1745.
- Hartmann K, Egberink H, Möstl K, Addie DD, Belák S, Boucraut-Baralon C, et al. Feline Injection-Site Sarcoma and Other Adverse Reactions to Vaccination in Cats. Viruses. 8 août 2023;15(8):1708.
