> Ponction épanchement péricardique et pleural
Montpellier France
I- Thoracocentèse
L'épanchement pleural est l'accumulation de liquide (transsudat, transsudat modifié, exsudat, chyleux, hémorragique, etc.) dans l'espace pleural thoracique. Il existe de nombreuses causes d'épanchement pleural qui peuvent être réduites en prélevant et en analysant le liquide pleural (y compris les analyses cytologiques).
L'aspect clinique de l'épanchement pleural dépend de l'importance de l'épanchement, les cas bénins ayant peu ou pas de signes et les cas graves démontrant une insuffisance respiratoire importante.
1. Pronostic
Le pronostic dépend de la cause de l'épanchement pleural. Dans certains cas (pyothorax), la mise en place d'un drain thoracique est nécessaire pour faciliter un drainage régulier pendant que la cause sous-jacente est traitée.
2. Risques
Les principaux risques de la thoracocentèse sont :
- Pneumothorax iatrogène ; risque accru chez les patients présentant un épanchement chronique ou des épanchements entraînant une pleurésie fibrosante, comme le chylothorax.
- Hémorragie si lacération des artères intercostales ou du système vasculaire pulmonaire. Un positionnement approprié peut aider à les éviter.
3. Points clés
- La thoracocentèse peut être à la fois diagnostique et thérapeutique.
- Le pneumothorax iatrogène est un risque de la procédure. Certains types d’épanchements pleuraux et leur durée de présence peuvent augmenter ce risque.
- L'échographie n'est pas obligatoire, mais c'est un outil utile pour aider à l'identification et à l'élimination du liquide pleural.
4. Causes courantes
- Corps étranger migrant ou plaie pénétrante (pyothorax).
- Traumatisme (hémothorax).
- Idiopathique (chylothorax).
- Insuffisance cardiaque (hydrothorax ; insuffisance cardiaque du côté gauche chez le chat et parfois du côté droit chez le chien).
- Néoplasie (hydrothorax, hémothorax).
- Hypoalbuminémie (hydrothorax).
- Coagulopathie (hémothorax).
5. Tests diagnostiques
a) Radiographies thoraciques
- Parfois, la cause sous-jacente peut être identifiée une fois le liquide pleural retiré.
- La prise de radiographies post-thoracocentèse est importante.
- Peut aider à déterminer la quantité et le côté (le cas échéant) de l'épanchement pleural
- Une vue ventrodorsale est recommandée par rapport à une vue dorsoventrale en raison de la façon dont le liquide pleural s'accumule.
- La stabilité du patient prime sur l'imagerie et des précautions doivent être prises pour surveiller de près une décompensation aiguë pendant les radiographies.
b) Échographie thoracique
- Peut occasionnellement identifier la cause sous-jacente.
- Certains vétérinaires préfèrent l'échographie pour identifier le liquide puis radiographies post-thoracocentèse.
- Peut aider à l'identification et à l'élimination du liquide.
c) Analyse cytologique
- Extrêmement important comme étape de diagnostic.
- Si la cytologie est compatible avec un processus infectieux, un examen cytobactériologique est conseillé.
d) Tomodensitométrie (scanner)
- Fournit une étude d'imagerie plus détaillée du thorax et peut être utilisée pour identifier les causes sous-jacentes.
- Comme la sédation ou l'anesthésie est souvent utilisée pour maintenir le patient immobile, la stabilisation avant le scanner est préférable.
6. Équipement
- Tondeuses/scrub/champ chirurgical/gants stériles.
- Seringue de 20 à 60 cc.
- Cathéter de 14 à 20Ga/épicranienne/angiocathéter suivant matériel disponible/taille animal.
- Robinet d'arrêt à 3 voies et kit d'extension.
- Tube EDTA et sec pour le prélèvement d'échantillons.
7. Procédure
- Sédation légère selon les besoins pour le confort du patient, en tenant compte de la stabilité du patient.
- Décubitus sternal ou latéral.
- Un bloc local de lidocaïne peut aider avant l'insertion du cathéter en essayant d'anesthésier aussi la plèvre.
- Dans certains cas, une petite entaille dans la peau est faite pour faciliter l'insertion du cathéter.
- Préparation aseptique de la zone d'intérêt.
- Insertion du cathéter, généralement au niveau du 6e au 10e espace intercostal cranialement à la côte.
- Une fois que le cathéter/stylet est dans la cavité thoracique, il est avancé lentement jusqu'à ce qu'il y ait un « flash » de liquide dans la garde du cathéter : retrait du stylet puis attache du système de collecte pour le drainage.
- Prélèvement de l'échantillon pour analyse puis retrait de l'épanchement.
II- Péricardiocentèse
L'épanchement péricardique est l'accumulation anormale de liquide dans le sac péricardique, le sac qui renferme le cœur et les racines des gros vaisseaux.
Deux formes chez le chien : figure 1
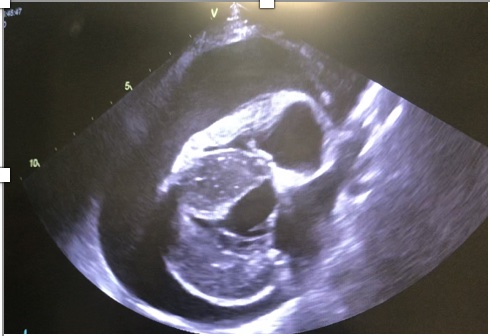
Figure 1
- Épanchement aigu, avec compression diastolique du cœur droit (tamponnade cardiaque), entraînant une diminution du remplissage et par conséquent une diminution du débit cardiaque et de la pression artérielle (choc).
- Épanchement chronique, avec augmentation compensatoire de l'eau corporelle totale et accumulation de liquide dans les troisièmes espaces, c'est-à-dire insuffisance cardiaque congestive du côté droit.
- Causes courantes chez le chien: péricardite idiopathique, hémangiosarcome, plus rarement tumeur de la base du cœur (chémodéctome), intoxication aux anticoagulants, rupture atriale, cause septique (corps étranger)
Le chat aussi peut souffrir d’épanchement péricardique même si cela est bien moins courant.
- Causes chez le chats : néoplasie (lymphome), infectieux (PIF), cardiaque.
L'apparence clinique et le signalement sont similaires à ceux des patients atteints d'hémoabdomen (choc hypovolémique/obstructif) : à envisager sur tout chien ayant des antécédents de collapsus aigu ou sur tout chien présentant les signes cliniques d’hypovolémie.
Le temps de prothrombine peut être réalisé avant le ponction pour exclure la possible cause d'intoxication aux rodenticides. Le diagnostic échocardiographique d'une tumeur cardiaque provoquant un épanchement péricardique est difficile quand il n'y a plus l'épanchement. Il faut donc peser le risque/bénéfice sur une ponction avant écho.
1. Pronostic
Le pronostic dépend de la cause. L'épanchement idiopathique se reproduira dans environ 50 % des cas, mais peut être géré avec succès dans la plupart des cas. Le pronostic avec hémangiosarcome est mauvais à grave. Les tumeurs de la base du cœur se développent lentement. Des péricardiocentèses répétées peuvent être réalisées. Une péricardectomie peut également être indiquée.
2. Traitement initial
- Oxygénothérapie (flow-by, masque nasal, cage à oxygène, intubation).
- Fluide bolus : 10-20 mL/kg bolus de cristalloïdes avant la péricardiocentèse + réévaluation de la volémie. Des volumes plus importants peuvent être nécessaires.
- Les diurétiques ne sont pas indiqués pour les épanchements aiguës et aggravent les choses en diminuant le débit cardiaque.
3. Tests diagnostiques
- Échocardiographie - test de choix pour la confirmation de l'épanchement.
- Une masse, si elle est présente, peut souvent être identifiée. Cependant, trouver et identifier l'emplacement correct dépend de la compétence de l'échographiste. La plupart des hémangiosarcomes sont situés sur l'oreillette droite. La plupart des tumeurs de la base du cœur sont situées entre l'aorte et l'artère pulmonaire principale.L'absence de masse visible ne l'exclut pas.
- Électrocardiographie (ECG) : arythmies ventriculaires possibles, complexes QRS réduits en taille, alternance électrique (variation de la taille du QRS due au mouvement anarchique du coeur dans le péricarde).
- Radiographie thoracique — Evitez le stress ! La vue ventrodorsale doit être évitée. La vue dorsoventrale peut minimiser le stress. Silhouette cardiaque globoïde, peut être absent pour les cas aigus ; veine cave caudale distendue due à des pressions diastoliques auriculaires/ventriculaires droites élevées ; mauvais détail abdominal si présence d'une ascite.
4. Équipement pour la procédure (figure 2)
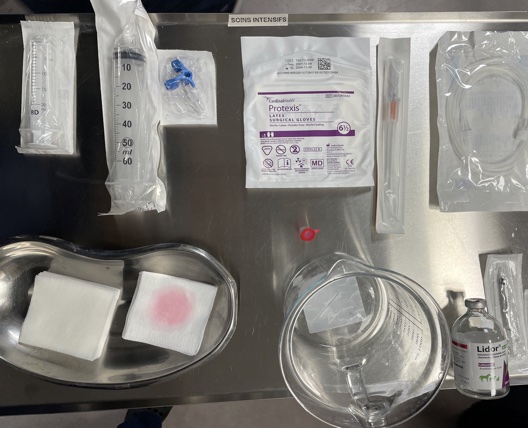
Figure 2
- Tondeuses/scrub/champ chirurgical/gants stériles.
- Seringue 20-60 cc.
- Cathéter de 14-20 Ga ou angiocathéter ou épicranienne ou kit de péricardiocentese dépendant la taille de l’animal et le matériel a disposition.
- Robinet 3 voies et lignes d'extension.
- Récipient .
- Tubes pour le prélèvement des échantillons.
5. Procédure
La sédation peut être utile en utilisant des sédatifs épargnant le système cardiovasculaire tels que les narcotiques et les benzodiazépines (évitez l'acépromazine et les agonistes alpha-2).
- Décubitus sternal ou latéral.
- Lidocaïne locale peut aider avant l'insertion du cathéter.
- Petite entaille dans la peau pour faciliter l'insertion.
- ECG et/ou écho-surveillance pendant la procédure.
La ponction doit être effectuée sur le côté droit. Préparation chirurgicale entre les 2e et 8e côtes ; jonction sternum-costochondrale.
Le battement d'apex du cœur est palpé ou un guidage échographique peut être utilisé. Le cathéter est inséré et avancé du bord crânien de la côte à l'emplacement du battement de l'apex.
Une fois que le cathéter/stylet est dans la cavité thoracique, il est avancé lentement jusqu'à ce qu'il y ait un « flash » de liquide dans le cathéter. Ne pas retirer du stylet tant que cela n'est pas observé. Un « pop » doux est parfois ressenti lorsque le péricarde est perforé.
Le cathéter et le stylet sont ensuite avancés ensemble de 2 à 3 mm supplémentaires et le cathéter est ensuite introduit sur le stylet dans le péricarde. Le placement peut être confirmé en injectant un petit volume de solution saline agitée à travers le cathéter tout en observant par échographie - s'ils sont correctement situés, des bulles doivent apparaître dans l'espace péricardique.
Le stylet est ensuite retiré et le système de collecte attaché pour le drainage.
Après le prélèvement, le liquide est évacué dans le récipient.
6. Notes IMPORTANTES
- Si le cathéter a été accidentellement avancé dans le ventricule, l'échantillon coagulera : examinez le récipient à la recherche de caillots ou placez une partie du liquide dans un tube sec pour voir s'il coagule.
- Pendant la ponction, si une sensation de "grattage" est ressentie sur le cathéter, cela peut indiquer un contact avec le cœur (des extrasystoles ventriculaires peuvent également être observées à l'ECG). Le cathéter doit être rétracté pour éviter d'endommager le cœur.
- Parfois, le volume collecté est plus petit que prévu. Cela peut se produire si le péricarde se déchire pendant le cathétérisme et que l'épanchement péricardique pénètre dans l'espace pleural.
- La réponse du patient a la procédure est souvent immédiate et très gratifiante : les muqueuses deviennent plus roses, la préssion artérielle et la fréquence cardiaque s'améliorent, la détresse respiratoire diminue.
7. Considérations post-péricardiocentèse
- Réévaluation fréquente pour rechercher une récidive d'épanchement péricardique.
- Diagnostics supplémentaires s'ils n'ont pas déjà été effectués : NFS/Biochimie/Analyse urinaire.
- Radiographies thoraciques pour rechercher des signes de métastases pulmonaires.
8. Pièges
- Réanimation liquidienne inadéquate avant la péricardiocentèse.
- Pneumothorax dû à un traumatisme/une perforation du lobe pulmonaire.
- Tachycardie ventriculaire et arrêt cardiaque : la lidocaïne, l'adrénaline et l'atropine devraient être disponibles avec des doses calculées à l'avance.
- Lacération de l'artère coronaire.
> Ponction Humeur aqueuse
Maisons-Alfort France
I- Introduction
L’humeur aqueuse est le fluide translucide qui remplit la chambre antérieure et la chambre postérieure de l’œil. Elle est produite par le corps ciliaire, localisé en arrière de l’iris, remplit toute la chambre postérieure, passe à travers l’ouverture pupillaire, remplit la chambre antérieure, puis est éliminée majoritairement par l’angle iridocornéen chez le chien, et le chat, et dans une moindre mesure, par la voie uvéosclérale.
La production et l’élimination de l’humeur aqueuse donnent le tonus au globe oculaire, avec une pression intraoculaire mesurée par tonométrie se situant entre 15 et 20 mm Hg. Le volume moyen de l’humeur aqueuse est estimé à 0.8 ml dans la chambre antérieure chez le chien et le chat, et à 0.2 ml et 0.3 ml dans la chambre postérieure, respectivement chez le chien et le chat [1].
II- Indications
La ponction d’humeur aqueuse peut avoir un objectif de diagnostic ou thérapeutique. Elle est principalement envisagée lorsque des analyses cytologiques ou microbiologiques sont indiquées. Cependant, cet acte est parfois indiqué pour restaurer un tonus oculaire physiologique [2].
1. Exploration d’une atteinte inflammatoire ou tumorale du segment antérieur de l’œil
Le prélèvement de l’humeur aqueuse s’inscrit dans une démarche clinique d’exploration d’une atteinte inflammatoire (uvéite antérieure) ou tumorale (masse uvéale) du segment antérieur de l’œil.
Les analyses réalisées sur un prélèvement d’humeur aqueuse incluent :
- une analyse cytologique : principalement lors de suspicion de tumeur de l’uvée qui s’exfolie facilement, comme le lymphome uvéal ;
- une analyse par PCR dans un contexte d’uvéite antérieure : recherche d’agents infectieux, comme le coronavirus félin, lors de suspicion de PIF chez le chat ;
- un dosage d’anticorps dans un contexte d’uvéite antérieure pour le calcul de la C-value (production locale d’anticorps) ;
- plus rarement, une analyse bactériologique ou fongique, lors de suspicion d’endophtalmie microbienne.
2. Diminution brutale de la pression intraoculaire dans la prise en charge du glaucome aigu
Lors d’hypertension oculaire très marquée, il est possible de ponctionner un volume d’humeur aqueuse pour faire diminuer rapidement la pression intraoculaire et soulager ainsi l’animal de la douleur occasionnée par l’hypertension oculaire. Cet acte n’est pas définitif, l’humeur aqueuse se reconstituant très rapidement (entre 5 et 7 µL/min chez le chien et le chat) [1,2]. Un traitement de l’hypertension oculaire doit être mis en place de façon concomitante à la ponction.
3. Équilibre du tonus oculaire lors d’une injection intracamérulaire ou intravitréenne
Selon le volume injecté dans la chambre antérieure ou dans le vitré, une hypertension oculaire peut survenir. Dans ce cas, une ponction d’humeur aqueuse d’un volume équivalent à celui injecté permet d’équilibrer le tonus oculaire de l’œil traité [2].
III- Technique
1. Matériel nécessaire
La ponction d’humeur aqueuse ne nécessite pas de matériel hautement spécialisé. Le matériel nécessaire est listé ci-dessous :
- Un blépharostat ou écarteur à paupières
- Une pince de Paufique ou une pince à dents fines
- Une seringue de 1 ml
- Une aiguille de 25G (orange) ou de 26G (marron)
- Une éponge ophtalmique ou un coton-tige, stérile
- Solution de polyvidone iodée et de chlorure de sodium
- Tétracaïne collyre
- Gants stériles
Cet acte peut se réaliser sans système grossissant, ou à l’aide de lunettes loupes, selon l’appréciation du clinicien.
2. Réalisation [2,3]
La ponction d’humeur aqueuse n’est pas un acte douloureux. Elle peut se réaliser sur un animal vigile très calme, sous anesthésie topique. Cependant, pour limiter le risque de complications liées à un mouvement de l’œil ou de la tête de l’animal pendant la ponction, nous recommandons de réaliser cet acte sous forte sédation ou anesthésie générale, complétée par une anesthésie topique des surfaces oculaires par instillation de Tétracaïne collyre ND.
Les surfaces oculaires sont désinfectées avec une solution de polyvidone iodée (Vétédine solution dermatologique à 10% diluée dans du chlorure de sodium stérile, à une concentration finale de 2.5-5 % ou Bétadine solution oculaire à 5%). Les paupières sont maintenues ouvertes à l’aide d’un blépharostat ou d’un écarteur à paupières. La conjonctive bulbaire est maintenue à l’aide d’une pince de Paufique ou à dents fines à proximité du site de ponction. En théorie, la ponction peut être réalisée sur toute la circonférence du globe oculaire, mais en pratique, pour le confort du clinicien et pour ne pas être gêné par la membrane nictitante chez les carnivores domestiques, la ponction est réalisée dans le quadrant dorsal ou dorsotemporal.
La seringue est montée sur l’aiguille fine, qui est introduite lentement, biseau dirigé vers le haut, dans la chambre antérieure en traversant la cornée juste en avant du limbe sclérocornéen (figure 1). Lors de l’introduction de l’aiguille dans la cornée, il est recommandé de « tunneliser » le site de perforation pour éviter une fuite d’humeur aqueuse prolongée au moment du retrait de l’aiguille. L’aiguille doit rester dans un plan parallèle au plan de l’iris, et est guidée de manière à ne pas toucher ni l’iris, ni la capsule antérieure du cristallin, ni l’endothélium cornéen. Lorsque l’aiguille est suffisamment introduite dans la chambre antérieure, l’humeur aqueuse est aspirée lentement à l’aide de la seringue. Plusieurs techniques sont possibles selon l’expérience du clinicien. Pour éviter tout mouvement indésirable sur l’aiguille, nous recommandons de ne pas travailler à « deux » personnes, c’est-à-dire de réaliser la ponction à l’aiguille et l’aspiration à la seringue par le même clinicien.
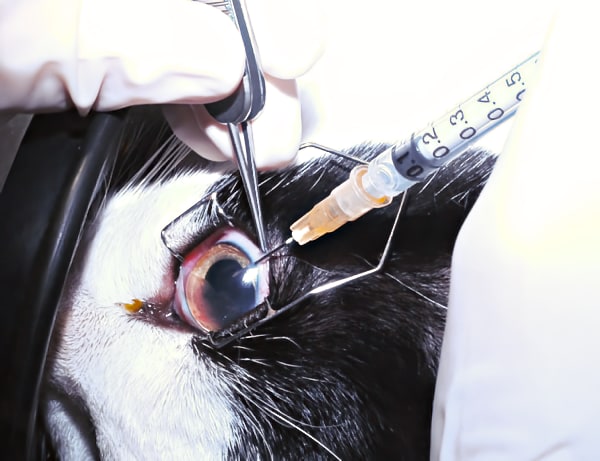
Figure 1 : Paracentèse de la chambre antérieure chez un chat. (crédit : Sabine Chahory)
Le volume d’humeur aqueuse que l’on peut prélever varie selon les espèces : de 0.3 à 0.7 ml chez le chien et 0.5 à 0.6 ml le chat, selon le tonus oculaire de l’œil et la profondeur de la chambre antérieure. Pour limiter le risque d’une hypotonie sévère après le prélèvement d’un volume important d’humeur aqueuse, certains auteurs préconisent de remplir la chambre antérieure par un volume équivalent de chlorure de sodium [2]. Selon notre expérience, cette pratique augmente le risque de complications en raison des manipulations de l’aiguille alors que celle-ci est introduite dans la chambre antérieure. Notre expérience personnelle nous incite à recommander d’ajuster le volume du prélèvement à la profondeur de la chambre antérieure et au tonus oculaire de l’animal et réduire le volume prélevé si nécessaire.
Lorsque le prélèvement est terminé, l’aiguille est retirée délicatement et une éponge ophtalmique stérile (ou un coton-tige stérile) est appliquée sur le site de ponction pendant quelques secondes à quelques minutes, jusqu’à étanchéité du site de perforation.
Une variante de cette technique consiste à introduire l’aiguille sous la conjonctive bulbaire en direction du limbe puis à piquer au travers de la sclère à 1-1.5 mm du limbe pour entrer dans la chambre antérieure [3].
Recommandations
- Ne pas hésiter à réaliser cette ponction sous sédation ou une anesthésie générale de courte durée pour se placer dans les conditions optimales et limiter les risques de complications.
- Lors du réveil de l’animal, limiter tout stress ou état d’agitation (mouvements brutaux de la tête), qui pourrait favoriser un saignement intraoculaire. De même, recommander de ne pas tirer excessivement sur le collier du chien.
3. Traitement du prélèvement d’humeur aqueuse
Comme pour tout prélèvement, pour optimiser les résultats des analyses, il est conseillé de suivre les recommandations de conservation et d’acheminement du prélèvement du laboratoire receveur.
Pour une analyse par PCR, le volume d’humeur aqueuse recommandé est généralement faible : 0.3 ml, conservé dans un tube EDTA. Pour une analyse cytologique, un volume de 0.2 ml peut suffire, conservé dans un tube EDTA ; il est indispensable d’acheminer le prélèvement très rapidement au laboratoire, et de demander une ultracentrifugation du prélèvement.
IV- Complications
1. Déchirure de la conjonctive bulbaire
Sur un animal vigile, non sédaté, un mouvement de tête brutal peut entrainer une déchirure de la conjonctive bulbaire si le clinicien n’a pas le temps de retirer la pince à dents qui maintient la conjonctive. Dans ces conditions d’un animal non tranquillisé, nous recommandons de ne pas agripper la conjonctive bulbaire à l’aide d’une pince à dents, acte qui est mal toléré car douloureux, même sous anesthésie topique.
2. Hyphéma
Un saignement dans la chambre antérieure peut survenir si l’aiguille a lésé l’iris, ou spontanément suite à la ponction, lors d’hypotonie sévère ou suite à la rupture de la barrière hémato-aqueuse qui accompagne une uvéite antérieure (2).
3. Lésions cristalliniennes ou cornéennes
Lors de mouvement non contrôlé de l’aiguille lorsque celle-ci est introduite dans la chambre antérieure, le risque de léser la capsule antérieure du cristallin ou l’endothélium cornéen est possible, avec des conséquences qui peuvent être sérieuses : cataracte et uvéite phacoclastique en cas de rupture de la capsule du cristallin, œdème cornéen en cas de lésion de l’endothélium (2). Ces complications sont exceptionnelles si l’animal est sédaté ou anesthésié.
4. Fuite d’humeur aqueuse sur le site de ponction
Le site de ponction se referme spontanément très rapidement, surtout dans un contexte d’uvéite. La production de fibrine au moment du prélèvement rend le site de perforation rapidement étanche. Il peut arriver cependant que le site de ponction reste perméable pendant plusieurs minutes, occasionnant une fuite d’humeur aqueuse (observations personnelles).
Pour limiter ce risque, nous recommandons d’utiliser une aiguille très fine (26 G, voire 27G) et de « tunneliser » la cornée au moment de l’introduction de l’aiguille.
En cas de fuite d’humeur aqueuse, une tamponnade à l’aide d’une éponge ophtalmique pendant quelques minutes suffit généralement à rendre le site de ponction étanche.
5. Contamination endoculaire septique
L’introduction d’un agent infectieux dans la chambre antérieure au moment de la perforation cornéenne est toujours possible. Pour limiter ce risque, nous recommandons une désinfection chirurgicale des surfaces oculaires et le port de gant stériles au moment de la ponction.
V- Conclusion
La ponction d’humeur aqueuse est une technique simple à réaliser. Lorsque les conditions de réalisation sont adaptées, les complications sont rares et bénignes. Selon notre expérience, cet acte peut être réalisé dans le cadre d’une pratique généraliste.
Les analyses réalisées sur le prélèvement de l’humeur aqueuse présentent un intérêt diagnostique notamment dans l’exploration d’une origine infectieuse d’une uvéite antérieure.
Bibliographie
- Hendrix DVH, Thomasy SM, Gum GG. Physiology of the Eye. In: Veterinary Ophthalmology Edited by Gelatt KN, Ben-Shlomo G, Gilger BG, Hendrix DVH, Kern TJ, Plummer CE. 6th éd. Hoboken (USA): John Wiley&Sons; 2021. p. 124-67.
- Featherstone HJ, Heinrich CL. Ophthalmic Examination and Diagnostics. Part 1: The Eye Examination and Diagnostic Procedures. In: Veterinary Ophthalmology Edited by Gelatt KN, Ben-Shlomo G, Gilger BG, Hendrix DVH, Kern TJ, Plummer CE. 6th éd. Hoboken (USA): John Wiley&Sons; 2021. p. 564-661.
- Chaudieu G, Bouhanna L. Ophtalmologie féline Atlas et manuel. MED’COM. 2018. 280 p.
> La ponction du liquide cérébrospinal
Saint Priest France
I- Introduction
La ponction du liquide cérébrospinal (LCS) est une procédure diagnostique couramment réalisée en neurologie. Ce geste technique relativement simple demande une pratique régulière pour être tout à fait sûr. Un prélèvement mal réalisé peut être responsable d’une contamination sanguine de l’échantillon et parfois entrainer la mort de l’animal. Les techniques d’analyse immédiate du LCS sont facilement accessibles et demandent un minimum d’équipement : une cellule de Malassez, une bandelette urinaire et un microscope. Les informations obtenues par l’examen du LCS sont nombreuses mais rarement spécifiques. Cet examen permet essentiellement de différencier les affections inflammatoires (primaires ou secondaires) du système nerveux central. Les principales contre-indications se limitent à l’anesthésie générale et aux cas de suspicion d’hypertension intracrânienne.
II- Physiologie
Le LCS est essentiellement produit par les plexus choroïdes tapissant les ventricules cérébraux. Ces structures vasculaires provenant de la pie-mère sont présentes dans les ventricules latéraux et le plafond des troisième et quatrième ventricules. Le LCS est produit de façon continue et distribué dans les ventricules cérébraux et l’espace sous-arachnoïdien. Il circule de façon prédominante selon un flux caudal depuis les ventricules cérébraux vers le cône dural. Il est majoritairement réabsorbé par les sinus veineux des villosités arachnoïdiennes. Le volume total du LCS est produit et réabsorbé 3 à 5 fois par jour à la vitesse de 0,05 mL/min chez le chien et 0,02 mL/min chez le chat. Élaboré par filtration du plasma et divers phénomènes de transport actif, sa composition est assez similaire au plasma sanguin. Sa production est indépendante de la pression intracrânienne ; son absorption est le principal mécanisme régulateur homéostatique pour maintenir la pression intracrânienne. En plus du rôle de protection mécanique du système nerveux central, le LCS a une fonction nutritive et de transporteur, assurant la communication entre la circulation sanguine et le parenchyme nerveux.
III- Technique de prélèvement
Deux sites de ponction sont possibles :
- Une ponction atlanto-occipitale haute dans la citerne cérébellomédullaire
L’animal est placé en décubitus latéral ; un opérateur maintient la tête en flexion à 90° dans un plan parallèle à la table. En arrière de l’occiput, une dépression entre les muscles cervicaux est palpée. L’aiguille est alors placée sur la ligne médiane, au centre d’un triangle délimité par les ailes de l’atlas et la pointe de l’occiput. L’aiguille est ensuite enfoncée, biseau vers l’arrière, en prenant soin de rester dans le plan médian, juste en arrière de l’occiput jusqu'à atteindre l’espace sous arachnoïdien dorsal. Une résistance est souvent ressentie au passage de la membrane atlanto-occipitale dorsale. À ce moment-là, le retrait du mandrin entraîne la montée du LCS dans l’aiguille. Le liquide est alors récolté au goutte-à-goutte à l’aide d’une seringue ou d’un tube sec ouvert. Un millilitre pour cinq kilos peut être récolté. Ces différentes étapes nécessitent un peu d’entraînement pour être bien identifiées par l’opérateur.
- Une ponction lombaire basse possible dans les trois derniers espaces intervertébraux
L’espace intervertébral de prédilection est L5-L6 (ou L6-L7 chez les chats et les petites races). L’animal est placé en décubitus ventral ou latéral. L’aiguille est introduite et descendue crânialement au processus épineux de L6 jusqu’à rencontrer le plafond vertébral. Elle est alors inclinée jusqu’à l’introduction dans l’espace intervertébral. L’examen peut être réalisé sous contrôle radiographique ou scanner afin d’évaluer l’anatomie des processus épineux et diriger l’aiguille. Du fait de la faible épaisseur de l’espace sous arachnoïdien dans cette région, il n’est pas toujours possible du recueillir du LCS et les contaminations sanguines sont fréquentes. La collecte du LCS doit toujours avoir lieu avant une myélographie car les agents de contraste peuvent modifier l’aspect des cellules et être responsables d’une méningite aseptique réactionnelle transitoire pendant plusieurs jours.
Étant donné le flux essentiellement caudal du LCS, il est conseillé de collecter le liquide en aval et à proximité de la lésion. Aussi, si la lésion se situe en région thoracolombaire, il est conseillé de faire une ponction lombaire. En effet, le LCS prélevé par voie cisternale pourrait ne pas être représentatif de l’affection sous-jacente. Pour les patients présentant une lésion cérébrale ou cervicale, il est parfois bénéfique de collecter le LCS sur les deux sites, en région atlanto-occipitale et lombaire [1].
Les complications associées au prélèvement du LCS sont rares lorsque la technique est maitrisée [2]. Les principales contre-indications se limitent à l’anesthésie générale et aux cas d’hypertension intracrânienne. Cette dernière contre-indication est motivée par le risque de hernie sous tentorielle ou occipitale résultant d’une baisse brutale de la pression du LCS suite à la ponction. La contamination du prélèvement par du sang survient le plus souvent lorsque l’aiguille lèse un sinus veineux paramédian. Le risque de contamination sanguine est plus élevé pour les praticiens peu expérimentés et en région lombaire. Lorsque le prélèvement est contaminé, les premières gouttes ne sont pas récoltées ; généralement le prélèvement s’éclaircit par la suite.
IV- Conservation du LCS
Le LCS doit être récolté sur tube sec ou EDTA. Le prélèvement doit être acheminé en main propre au laboratoire le plus rapidement possible (en moins de 1h) et doit être conservé à température ambiante. Une étude a montré que plus de 30% des cellules du LCS ne sont plus identifiables après une période de 24h à une température de 4°C, et plus de 50% après une durée de 48h [3]. La probabilité d’une mauvaise interprétation du LCS est plus élevée pour les échantillons comportant une faible cellularité ou une faible teneur en protéines [4]. Pour les échantillons comportant une concentration en protéines élevée > 0,5 g/L, l’interprétation du LCS sera moins altérée. En l’absence de lecture immédiate du LCS, il est conseillé d’ajouter quelques gouttes de sérum autologue au prélèvement afin de favoriser la conservation des cellules.
V- Interprétation du LCS
Les principales informations récoltées via ce prélèvement sont :
- l’aspect physique du LCS : le LCS normal est limpide dit « eau de roche ». Une coloration rosée apparait lors d’une contamination iatrogène ou lors d’un traumatisme, une couleur jaunâtre (xanthochromie) signale une hémorragie ancienne. La turbidité indique généralement un comptage de cellules nucléées élevé ;
-
la concentration protéique : l’augmentation de la concentration protéique est appelée protéinorachie. Ce taux ne doit pas dépasser 0,25 g/L. Le taux de protéines peut augmenter en cas de nécrose parenchymateuse, perturbation du flux du LCS, production intrathécale de globulines ou une rupture de la barrière hématoméningée ;
-
la cytologie : le LCS normal ne contient pas de globules rouges et très peu de cellules (moins de 5 GB/µL). Une augmentation du nombre de cellules est appelée une pléiocytose ;
-
le lactate : la concentration de lactate dans le LCS est significativement plus élevée chez les chiens affectés par un processus inflammatoire ou tumoral que chez un chien épileptique idiopathique. La valeur normale du lactate dans le LCS se situe entre 1 et 2.5 mmol/L.
La dissociation albuminocytologique se traduit par une augmentation de la concentration en protéines avec un taux de cellules nucléées normal. Cette anomalie est souvent présente pour les maladies qui altèrent la barrière hémato-encéphalique, augmentent la production de protéines ou obstruent le flux du LCS. Elle est souvent observée lors de neuropathie des nerfs crâniens, tumeur cérébrale, syndrome vestibulaire idiopathique et parfois lors d’accident vasculaire cérébral [5].
En pratique courante, l’aspect physique est évalué dès le prélèvement réalisé. L’examen cytologique du LCS doit être fait le plus rapidement possible (dans la demi-heure). Le comptage cellulaire peut être effectué à l’aide d’une cellule hématimétrique (cellule de Malassez). Si l’échantillon est lu après plusieurs heures par un laboratoire, le différentiel cellulaire sera modifié secondaire à une détérioration rapide des cellules (surtout les cellules mononuclées). Les protéines peuvent être estimées à l’aide d’une bandelette urinaire ou d’un réfractomètre. Des maladies infectieuses peuvent être recherchées directement sur le LCS (PCR ou sérologie). La bactériologie n’est pas systématique.
| Cytologie | Affections |
| Pléiocytose neutrophilique marquée (> 100 GB/µL) | Méningite bactérienne, syndrome méningite artérite répondant aux corticoïdes, PIF |
| Pléiocytose neutrophilique légère à modérée (< 100 GB/µL) | Embolie fibrocartilagineuse, méningite post-myélographie, tumeurs |
| Pléiocytose mixte | Méningite fongique ou à protozoaires |
| Pléiocytose mononuclée | Méningite virale (maladie de Carré), ehrlichiose, méningo-encéphalomyélites à médiation immunitaire |
| Pléiocytose éosinophilique | Parasitose, méningite éosinophilique |
Bibliographie
-
Lampe R et coll. Comparison of cerebellomedullary and lumbar cerebrospinal fluid analysis in dogs with neurological disease. J Vet Inter Med. 2020 ; 34 (2) : 8
-
Fentem R et coll. Complications associated with cerebrospinal fluid collection in dogs. Vet Rec. 2023;
-
Bienzle D et coll. Analysis of cerebrospinal fluid from dogs and cats after 24 and 48 hours of storage. J Am Vet Med Assoc. 2000 ; 216 (11): 1
-
Fry M et coll. Effects of time, initial composition, and stabilizing agents on the results of canine cerebrospinal fluid analysis. Vet Clin Pathol. 2006 ; 35 :
-
Sunol A et coll. Cerebrospinal fluid analysis in dogs: Main patterns and prevalence of albuminocytological dissociation. Vet Rec. 2021 ; 188 (5).
