> L'autopsie des chiots et des chatons
Maisons-Alfort France
I- Introduction
L’autopsie du chiot et du chaton a lieu principalement dans deux contextes distincts :
- Il peut s’agir de cas en élevage, impliquant un ou plusieurs animaux et se manifestant le plus souvent par des avortements ou de la mortalité périnatale ou post-natale (7-10 premiers jours de vie). L’autopsie est demandée par l’éleveur et a pour but de déterminer la ou les causes de mortalité afin d’appliquer les mesures thérapeutiques et préventives au reste de l’élevage[1–3] ;
- Il peut aussi s’agir de cas individuels avec une mortalité après une vente. Le demandeur est alors l’acheteur et l’autopsie s’inscrit dans un contexte de litige potentiel avec le vendeur.
Afin de répondre au mieux aux questions des demandeurs, l’autopsie doit, comme pour un animal adulte, suivre une démarche rigoureuse. Plus souvent que chez l’adulte, une cause infectieuse est recherchée ou suspectée a priori, et le protocole doit donc prévoir des étapes de prélèvements adéquats[1–3].
II- Technique
L’autopsie doit être effectuée le plus rapidement possible après la mort afin, notamment, de limiter les altérations cadavériques (autolyse et putréfaction). Si l’autopsie ne peut être effectuée immédiatement, la conservation du corps au froid positif (+4°C) doit être préférée à la congélation. Cette dernière ne doit être envisagée que lorsque l’autopsie est différée de plusieurs jours.
Avant de débuter l’autopsie, il est primordial de recueillir des éléments anamnestiques aussi précis que possible auprès de l’éleveur et/ou du propriétaire (contexte, antécédents de l’élevage, vaccination, entrée de nouveaux animaux, traitements administrés à la mère, signes cliniques ayant précédé la mort (souvent frustes chez les nouveau-nés), date d’achat, date de la mort etc.). En effet, les informations recueillies peuvent déjà orienter vers des suspicions qui influeront sur les examens complémentaires à effectuer en priorité. En cas de potentiel litige acheteur-vendeur, il est essentiel de relever l’identification de l’animal.
Avant de débuter l’autopsie, il convient de rassembler et de préparer le matériel de dissection, de prélèvements ainsi qu’un support pour le relevé des lésions (formulaires types disponibles[1]).
L’autopsie débute par un examen externe, incluant les orifices, à la recherche de malformations, de signes de traumatisme, de jetage etc. Si un contexte infectieux est suspecté, on peut pratiquer des écouvillonnages des muqueuses nasales, oculaires et/ou rectales (selon la suspicion).
Le cadavre est ensuite positionné en décubitus dorsal sur un support (bacs en plastique avec support en liège disponibles pour les petits animaux) et immobilisé (aiguilles, liens ou adhésifs) afin de travailler confortablement. En préparation des éventuels prélèvements bactériologiques internes, le site d’incision est désinfecté (alcool ou solution iodée). Une incision par des instruments stériles est ensuite pratiquée depuis l’appendice xyphoïde jusqu’à la symphyse pubienne en contournant l’ombilic et le pénis. La cavité thoracique est ouverte, initialement par incision du diaphragme, en vérifiant la présence d’un vide pleural. Immédiatement après l’incision et l’ouverture de chaque cavité, et en évitant les contaminations, un écouvillonnage des cavités abdominale et thoracique peut être effectué, notamment si l’on perçoit des signes d’inflammation (congestion, fibrine, pus). La rate peut être immédiatement prélevée pour analyse bactériologique si le contexte s’y prête (suspicion de septicémie).
Une fois les écouvillonnages effectués, les organes peuvent être inspectés in situ (aspect, position, taille, recherche d’épanchement etc.). On veillera à ne pas passer à côté de malformations congénitales, dont certaines peuvent facilement passer inaperçues (shunt porto-systémique, malformations cardiaques). Si une infection bactérienne est suspectée, des fragments d’organes pourront être prélevés : il s’agira généralement des « organes filtres » que sont les poumons, le foie, et les reins. En fonction de la suspicion, des prélèvements pour recherche virale par PCR peuvent également être effectués.
On procède ensuite à l’éviscération et à l’examen approfondi des organes à la recherche de lésions. L’absence de lésions macroscopiques ne présage en rien de l’absence de lésions microscopiques. A l’inverse, les altérations cadavériques peuvent constituer de « fausses lésions » qui sont autant de leurres.
L’encéphale est examiné après ouverture de la boite crânienne.
Tout au long de l’autopsie, il peut être utile d’effectuer des photographies. Celles-ci pourront être utiles en cas de demande de second avis ou dans les cas litigieux.
En fin d’autopsie, des prélèvements histologiques sont effectués et doivent concerner a minima tous les organes présentant des lésions macroscopiques. Même s’ils ne présentent pas de lésions macroscopiques, il est recommandé de prélever les poumons, le cœur, le thymus, des nœuds lymphatiques, le foie, la rate, les reins, les intestins et l’encéphale.
Les prélèvements bactériologiques sont à conserver à 4°C. Les prélèvements pour PCR peuvent être congelés. Quant aux prélèvements histologiques, ils peuvent être conservés en solution formolée indéfiniment.
III- Conclusion
Au final, bien que l’examen macroscopique seul ne permette pas toujours d'établir le diagnostic, notamment en cas de mortalités périnatale et néonatale, le recours aux examens complémentaires (histologie, bactériologie, PCR) contribue significativement à la détermination des causes de la mort[4].
Bibliographie
- Löhr CV. Postmortem Examination of the Puppy and Kitten. Small Animal Pediatrics. 2011;276–
- Mila H et coll. Réaliser une autopsie chez un chiot nouveau-né. Le Point Vétérinaire. 2021;(417):26–
- Mila H et coll. Guidelines for postmortem examination of newborn dogs. Anim Health Res Rev. 2021;22(2):109–
- Guérard C. Intérêt de l’autopsie et des examens complémentaires dans le diagnostic post-mortem chez le chiot nouveau-né. Thèse d’exercice vétérinaire, ENV de Toulouse. 2019:163 pages.
> Les vices rédhibitoires, comment les reconnaitre à l'autopsie
Maisons-Alfort France
Les vices rédhibitoires du chiot et du chaton ainsi que les modalités de recours associées sont définis par le code rural. Ces vices regroupent des maladies à déterminisme génétique et des maladies infectieuses. Pour le chiot, il s’agit de la parvovirose canine (Parvovirus canin de type 2), de la maladie de Carré (Morbillivirus canin), de l’hépatite de Rubarth (Adénovirus canin de type 1), de la dysplasie coxo-fémorale, de l’atrophie rétinienne et de l’ectopie testiculaire. Pour le chaton, il s’agit de la péritonite infectieuse féline ou PIF (coronavirus entérique félin muté), de la parvovirose féline ou typhus (Parvovirus de la panleucopénie féline) et des infections par le virus leucémogène félin (FeLV) et/ou le virus de l’immunodéficience féline (FIV)[1].
L’autopsie n’est généralement pas requise (ni même souhaitée !) pour le diagnostic des maladies à déterminisme génétique. Elles ne seront donc pas abordées ici.
FeLV & FIV
Concernant les maladies infectieuses du chat, les infections par le FIV et/ou le FeLV sont préférentiellement diagnostiquées par des tests sérologiques ou par PCR. Les lésions, lorsqu’elles sont présentes, sont généralement non spécifiques et davantage observées chez des animaux plus âgés.
Péritonite infectieuse féline
Les lésions de PIF se caractérisent par un grand pléomorphisme en termes de gravité et de localisation. Un épanchement jaune-citrin, visqueux, riche en protéines et assez pauvre en cellules est très évocateur des formes humides ou mixtes. Il n’est pas limité à la cavité péritonéale et peut être observé dans le thorax et/ou le sac péricardique, et ce, avec ou sans épanchement péritonéal associé. La PIF se manifeste également par de petits foyers blancs à jaunâtres d’aspect granuleux (pyogranulomes), généralement distribués le long des veines. Ceux qui peuvent être observés en surface des reins sont probablement les plus caractéristiques de la maladie (Figure 1) mais les pyogranulomes peuvent être observés dans n’importe quel organe. Ils sont parfois confluents et peuvent alors former des masses d’aspect pseudo-tumoral. Le diagnostic peut être confirmé par examen histologique et test RT-PCR à partir de prélèvements de tissus avec pyogranulomes ou d’épanchements.[2]
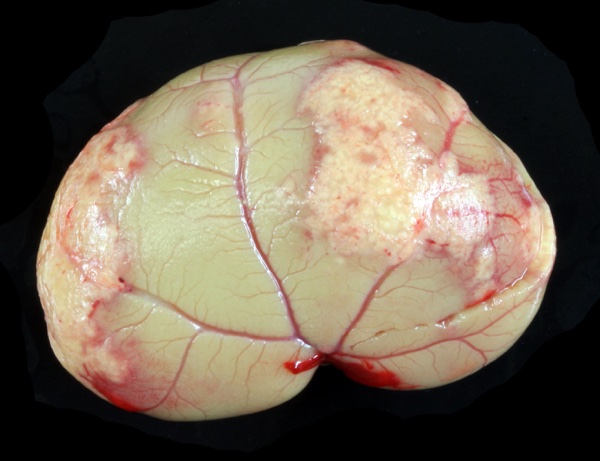
Figure 1
Parvoviroses
Chez le chiot et le chaton, les parvoviroses peuvent être suspectées par la présence de souillures diarrhéiques. Une congestion et des hémorragies de la séreuse intestinale, plus volontiers segmentaires que diffuses, sont des signes d’appel (Figure 2).
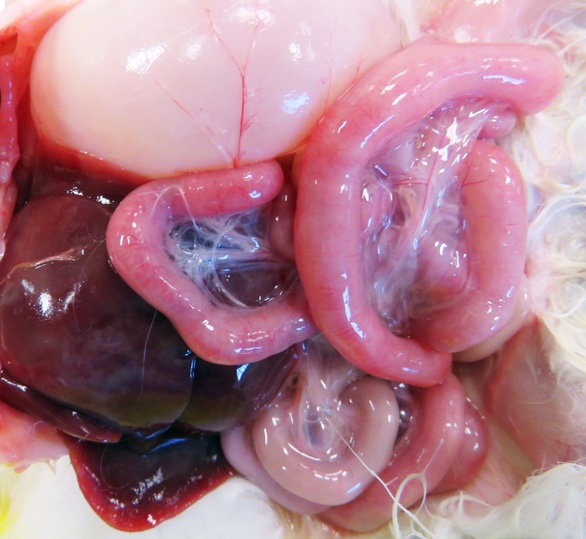
Figure 2
Il n’est cependant pas rare que les lésions soient minimes, voire à peine visibles (aspect légèrement granuleux de la séreuse). L’ouverture des anses intestinales peut permettre d’observer un contenu intestinal nécrotique à hémorragique, malodorant, s’accompagnant parfois de fibrine (entérite fibrino-nécrotique aiguë). On peut également noter une atrophie des organes lymphoïdes, en particulier du thymus. Les nœuds lymphatiques digestifs peuvent en revanche être hypertrophiés. Un examen histologique de l’intestin peut mettre en évidence des lésions typiques de parvovirose (nécrose des cryptes et présence d’inclusions virales) et l’on veillera donc à ne pas écraser ni gratter la muqueuse. Des tests ELISA ou PCR sur les selles, confrontés aux résultats histologiques, confirment le diagnostic.[2]
Hépatite de Rubarth
Lors d’hépatite de Rubarth, on peut observer des lésions hémorragiques du péritoine ainsi que des foyers de nécrose hépatique (foyers blancs/pâles disséminés). Une lésion très évocatrice est l’œdème de la paroi de la vésiculaire biliaire. Des lésions hémorragiques peuvent être observées dans d’autres organes (poumon, reins notamment), de même qu’un léger ictère. Le diagnostic peut être confirmé par examen histologique (inclusions virales dans les hépatocytes) et par tests PCR à partir de prélèvements hépatiques.[2]
Maladie de Carré
Lors de maladie de Carré, le tableau lésionnel est variable et l’éventail des lésions reflète l’atteinte multisystémique du virus. On pourra notamment observer des lésions de bronchopneumonie, atrophie des organes lymphoïdes, gastro-entérite, conjonctivite, myocardite, encéphalite. De nombreuses lésions sont difficilement observables macroscopiquement ou d’aspect non spécifique. Le diagnostic reposera donc surtout sur des prélèvements histologiques multiples à la recherche des inclusions virales (corps de Lentz) typiques de la maladie, combinés à des tests PCR sur tissus. A noter que les inclusions virales peuvent être particulièrement nombreuses dans la vessie et le bassinet.[2]
Bibliographie
- Peccavy C. Les différentes procédures judiciaires auxquelles un acheteur peut avoir recours. Guide juridique de la vente du chien et du chat. Editions Royal Canin ; 2008.
- Jubb, Kennedy, and Palmer’s pathology of domestic animals. 6th ed. San Diego : Elsevier Saunders ; 2007.
> Réaliser des prélèvements chez le chiot et le chaton dans un contexte infectieux
Nantes France
L'autopsie du chiot et du chaton : réalisation technique et prélèvements (NDLR : à ajouter au titre ??)
I- Introduction
L’autopsie permet l’observation des organes après la mort d’un animal et le cas échéant de réaliser des prélèvements afin de préciser la cause de la mort ou d’un état morbide. Dans le cas d’un nouveau-né, il peut permettre d’identifier la cause d’une mortinatalité isolée ou d’un épisode de mortalité néonatale au sein d’une un plusieurs portées.
La qualité et la pertinence des informations apportées par un examen nécropsique dépend d’un certain nombre de conditions préalables notamment
- Recueil de commémoratifs et de l’anamnèse
- Circonstances de la gestation et de la mise-bas ; historique de la portée
- Symptômes éventuels (animal, portée, mère)
- Traitements éventuels et statut sanitaire (historique médical, vaccinal, vermifugation…)
- Caractéristiques du lieu de vie (particulier, élevage)
- Informations sur la date de la mort et la conservation du cadavre
- Délai mort-autopsie (à réduire le plus possible)
- Mode de conservation : température ambiante, réfrigération (à privilégier), congélation (à proscrire).
II- Matériel requis
- Gants, lunettes, masques et combinaison de protection
- Planche/bac de dissection et lien
- Scalpel / Sonde cannelée
- Pinces mousse et à dents de souris
- Ciseaux de dissection
- Costotome (ostotome)
- Règle graduée
- Sacs en plastique
- Seringues (1, 5, 10 mL)
- Flacon/tubes/cassettes pour les prélèvements
- Appareil photo
- MODE OPERATOIRE ET DEROULEMENT
III- Protocole d’observation systématique (Thèse S. Lebouc, ENVA, 2005)
Prérequis : connaître l’anatomie normale de l’espèce et les caractéristiques liés à l’âge : taille relative des organes ; degré d’hydratation des tissus...
- Observation lésionnelle
- Examen externe du cadavre : peau, muqueuses, orifices (bouche, nez, anus, orifices génitaux) ; ombilic ; mobilisation squelette (crâne, rachis, rayons osseux des membres); volume abdominal
- Disposition et fixation du cadavre : décubitus dorsal (liens)
- Dépouillement entier : incision cutanée en croix, examen tissu conjonctif sous-cutané (degré d’hydratation, hémorragies)
- Ouverture cavité abdominale : ponction et incision sur la ligne blanche en contournant ombilic, collection d’un éventuel épanchement, examen des organes en place
- Ouverture cavité thoracique: ponction du diaphragme et appréciation du vide pleural (si absence, et incision sur la ligne blanche en contournant ombilic, collection d’un éventuel épanchement, examen des organes en place
- Eviscération en bloc
- Ouverture de la boîte crânienne
- Décrire et reporter
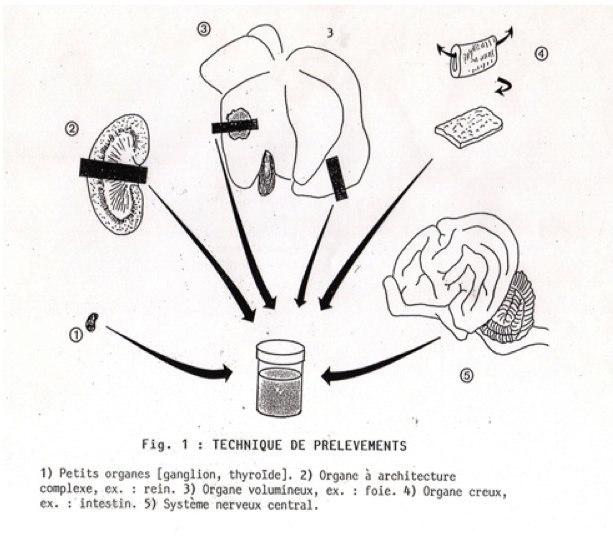
IV- Prélèvements pour examens complémentaires
- Complément (souvent indispensable) de l’examen macroscopique
- Délai mort-prélèvement crucial
- Préserver les tissus de la contamination, de l’autolyse
- Analyses
- Bactériologique (flacons ou tubes stériles; à réaliser avant toute ouverture de viscères; finir par les organes digestifs)
- Moléculaire (maladies infectieuses; écouvillon, organe, liquide biologique; attention aux contaminations; possible sur échantillons congelés)
- Histologique (attention au délai post-mortem et à la congélation)
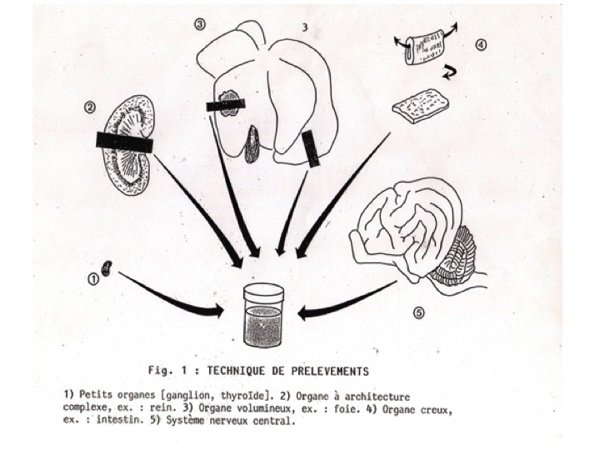
Figure 1
> Réaliser un bon prélèvement pour l'histologie
Nantes France
L'autopsie du chiot et du chaton : réalisation technique et prélèvements
I- Introduction
L’autopsie permet l’observation des organes après la mort d’un animal et le cas échéant de réaliser des prélèvements afin de préciser la cause de la mort ou d’un état morbide. Dans le cas d’un nouveau-né, il peut permettre d’identifier la cause d’une mortinatalité isolée ou d’un épisode de mortalité néonatale au sein d’une un plusieurs portées.
La qualité et la pertinence des informations apportées par un examen nécropsique dépend d’un certain nombre de conditions préalables notamment :
- recueil de commémoratifs et de l’anamnèse ;
- circonstances de la gestation et de la mise-bas ; historique de la portée ;
- symptômes éventuels (animal, portée, mère) ;
- traitements éventuels et statut sanitaire (historique médical, vaccinal, vermifugation…) ;
- caractéristiques du lieu de vie (particulier, élevage) ;
- informations sur la date de la mort et la conservation du cadavre ;
- délai mort-autopsie (à réduire le plus possible) ;
- mode de conservation : température ambiante, réfrigération (à privilégier), congélation (à proscrire).
II- Matériel requis
- gants, lunettes, masques et combinaison de protection ;
- planche/bac de dissection et lien ;
- scalpel / sonde cannelée ;
- pinces mousse et à dents de souris ;
- ciseaux de dissection ;
- costotome (ostéotome) ;
- règle graduée ;
- sacs en plastique ;
- seringues (1, 5, 10 mL) ;
- flacon/tubes/cassettes pour les prélèvements ;
- appareil photo.
III- Mode opératoire et déroulement
- protocole d’observation systématique (thèse S. Lebouc, ENVA, 2005)
- Prérequis : connaître l’anatomie normale de l’espèce et les caractéristiques liées à l’âge: taille relative des organes ; degré d’hydratation des tissus... ;
- observation lésionnelle ;
- examen externe du cadavre : peau, muqueuses, orifices (bouche, nez, anus, orifices génitaux) ; ombilic ; mobilisation squelette (crâne, rachis, rayons osseux des membres) ; volume abdominal ;
- disposition et fixation du cadavre : décubitus dorsal (liens) ;
- dépouillement entier : incision cutanée en croix, examen tissu conjonctif sous-cutané (degré d’hydratation, hémorragies) ;
- ouverture cavité abdominale : ponction et incision sur la ligne blanche en contournant ombilic, collection d’un éventuel épanchement, examen des organes en place ;
- ouverture cavité thoracique : ponction du diaphragme et appréciation du vide pleural (si absence) et incision sur la ligne blanche en contournant ombilic, collection d’un éventuel épanchement, examen des organes en place ;
- éviscération en bloc ;
- ouverture de la boîte crânienne ;
- décrire et reporter.
IV- Prélèvements pour examens complémentaires
- complément (souvent indispensable) de l’examen macroscopique ;
- délai mort-prélèvement crucial ;
- préserver les tissus de la contamination, de l’autolyse ;
- analyse :
- bactériologique (flacons ou tubes stériles; à réaliser avant toute ouverture de viscères; finir par les organes digestifs) ;
- moléculaire (maladies infectieuses; écouvillon, organe, liquide biologique; attention aux contaminations; possible sur échantillons congelés) ;
- histologique (attention au délai post-mortem et à la congélation).