> Examen clinique et examens complémentaires chez le nouveau-né : comment les interpréter?
Nantes France
I- Introduction
La prise en charge de très jeunes patients (de la naissance à 3 semaines) reste souvent un challenge pour le praticien et toute son équipe. La physiologie et la morphologie de ces animaux nécessitent une adaptation de nos gestes thérapeutiques en réponse à ces particularités.
II- Examen Clinique
1. Conditions de l’examen clinique
L’immaturité physiologique du nouveau né nécessite quelques précautions. L’examen est réalisé dans les conditions environnementales optimales (hygiène, température).
La présence de la mère est conseillée non seulement pour son côté « sécure » mais son examen ainsi que celui de l’ensemble de la portée sont conseillés (recherche d’une maladie infectieuse chez la mère, présence des symptômes chez les autres chiots, … )
2. Équipement
Il est adapté à la taille du patient : pèse-bébé voir balance de ménage, stéthoscope pédiatrique ou NAC. Les appareils d’analyse ne nécessitant qu’une très faible quantité de sang (glucomètre ou analyseur d’urgence) sont très utiles.
3. Recueil des commémoratifs
La consultation débute toujours par le recueil des commémoratifs et de l’anamnèse. Les questions porteront sur le malade mais aussi sur les conditions d’élevage (température, air, hygrométrie,…), la portée (alimentation de la mère et du chiot, traitement de la mère, passé reproducteur de la mère, nombre de petits atteints…) Les informations sur le déroulement de la prise colostrale sont à recueillir.
Ce recueil doit inclure non seulement le patient mais aussi l’ensemble de la portée, le déroulement de la mise-bas, celui de la prise colostrale sans oublier et l’expérience de l’éleveur
4. Examen clinique
- Le nouveau né est d’abord examiné à distance : mouvements spontanées, pleurs,… Il s’ensuit un examen rapproché plus classique où la pesée et la prise de température sont des éléments clés.
- On estime à 10% la prise de poids quotidienne les premières semaines de vie, soit un doublement du poids en 7 à 10 jours. Tout arrêt de croissance pondérale doit être considéré comme signe d’alerte.
- Le tégument est examiné à la recherche de souillures (vomissements, diarrhée, jetage,…), plaies, brûlures, parasites,… Le pli de peau est non significatif à cet âge. Le cordon ombilical tombe vers le 4ème jour. Un début d’alopécie ou une cyanose des extrémités peut évoquer un sepsis.
- La couleur des muqueuses est observée ; la recherche de malformations de la cavité buccale (fente palatine,…) systématique. Un doigt introduit dans la gueule permet d’évaluer le réflexe de succion et d’apprécier une éventuelle sécheresse des muqueuses.
- Le cordon ombilical doit être sec et sa base de la couleur du tégument.
- La palpation abdominale est délicate. Seuls le rein gauche, les intestins, le côlon et la vessie sont palpables. Les autres organes ne sont palpables qu’en cas d’hypertrophie. Les causes les plus fréquentes de distension abdominale sont l’aérophagie due à la douleur ou à une dyspnée, une maldigestion (caséification du lait,…), une rétention urinaire ou fécale. On observe parfois la présence de liquide dans la cavité, phénomène normal et non expliqué.
- L’examen neurologique du chiot n’est pas des plus faciles. Cependant la connaissance des grandes étapes de son développement permet d’apprécier la maturation de son système nerveux. En flexion les 4 premiers jours de vie, l’extension devient la posture dominante. Le chiot est capable de lever sa tête à la naissance, se tenir sur ses membres antérieurs à 10 jours et marcher à 2 semaines. Outre le réflexe de succion, deux autres tests sont réalisable : le test de repositionnement (righting reflex) : le chiot est placé sur le dos et doit être capable de se retourner rapidement ; a capacité du chiot à se diriger vers une source de chaleur (rooting reflex) est appréciée. Un cercle est créé entre le pouce et l’index du clinicien. Le nez du chiot est positionné dans ce cercle. L’animal doit effectuer un mouvement de pousser sur ce cercle.
- Les fontanelles sont examinées. L’absence de fermeture (1/3) n’est pas forcément pathologique.
III- Examens complémentaires
Pour étayer le diagnostic, des examens complémentaires peuvent être réalisés. Ces examens ne sont pas toujours des plus évidents chez le chiot (difficulté pratique de la prise de sang) et il faut noter que les valeurs usuelles diffèrent de chez l’adulte Les examens les plus utiles doivent être privilégiés: hématocrite, glycémie, Protéinémie, urémie plus une densité et culot urinaires. L’imagerie présente quelques particularités.
1. Analyse d’urine
Les urines sont recueillies par simple friction de la zone uro-génitale. La cystocentèse est déconseillée.
La densité urinaire (DU) est d’environ 1006-1017. Protéinurie et glucosurie normales les premières semaines ne sont plus de mise vers l’âge de 2 mois. L’incapacité du rein à concentrer ou diluer correctement les urines et une excrétion altérée du sodium demanderont d’adapter les volumes perfusés. Des urines jaunes, concentrées (DU > 1030 sont le signe d’une déshydratation.
2. Biochimie –hématologie
a) Réalisation des prélèvements
Le volume sanguin du nouveau né est de 50 à 80ml/kg. Le volume raisonnablement « prélevable » est de 1ml/100g. Les prélèvements sont réalisés de préférence à la veine jugulaire. Le chiot est tenu sur le dos par un aide qui lui tend le cou et la personne qui prélève maintient les membres antérieurs. Pour éviter le refroidissement, un tampon de chlorhexidine diluée est préféré à l’alcool.
b) Hématologie
Les muqueuses des nouveaux nés sont d’un rose plus vif que celles de l’adulte ce qui traduit un hématocrite plus élevé. Puis les hématies fœtales sont peu à peu remplacées, se traduisant le plus souvent par une hyperchromie, un taux élevé de réticulocytes, la présence d’hématies nucléées, la présence de corps de Howell-joly ou de Hienz (chaton).
Cette baisse progressive de l’hématocrite lors des 6 premières semaines de vie fait que toute perte sanguine peut devenir très vite fatale.
Les normes leucocytaires sont assez proches de celles de l’adulte. Chez le chiot, les lymphocytes et les neutrophiles sont relativement nombreux à la naissance puis décline durant le premier mois.
c) Biochimie
Glycémie
C’est sans doute le Paramètre le plus important à monitorer lors de syndrome de dépérissement. Selon Atkins, une glycémie inférieure à 30 mg/dl chez un chiot nouveau-né âgé de plus de deux semaines doit être considérée comme pathologique surtout si elle est associée à des signes cliniques évoquant notamment un syndrome de dépérissement du nouveau-né.
Système urinaire
Chez le chiot, l’urémie de valeur proche de l’adulte à la naissance chute entre 2 semaines et 3 mois sans doute par augmentation de la synthèse. Les valeurs de la créatinémie sont généralement élevées à la naissance puis diminuent jusqu’à l’âge d’un mois. Attention, ll’urémie est considérée comme meilleur témoin de la fonction rénale chez le nouveau né que la créatinémie.
Système hépato-biliaire
L’immaturité fonctionnelle du foie, la nature non spécifique des enzymes hépatiques et la production possible par d’autres tissus en croissance ainsi quenl’importance de la prise colostrale rendent l’interprétation des valeurs très difficiles . En effet, l'évaluation indirecte de la prise colostrale peut se faire par le dosage des phosphatases alcalines (PAL) sériques du chaton lors du premier jour de vie. En effet, si la concentration sérique de certains biomarqueurs es significativement augmentée chez les chatons nouveau-nés ayant accès à la mamelle comparés aux chatons privés de colostrum, seules les phosphatases alclaines (PAL) présentent un intérêt diagnostique à 24 h de vie : des PAL inférieures à 1500 UI/L permettent de diagnostiquer une absence de prise colostrale avec une sensibilité de 96 % et une spécificité de 93 %.
La protéinémie (TP) est faible chez le jeune car le volume plasmatique augmente plus rapidement que la synthèse protéique hépatique.
3. Imagerie
La réalisation d’examens d’imagerie est un véritable challenge pour le praticien; rendue difficile par la petite taille des patients, leur contention délicate et une sédation non pratiquée en routine.
a) Radiographie.
Les constantes choisies sont celles utilisées pour les NAC, les kVp sont le plus bas possible. Pour un animal en très bas âge, les kVp peuvent être descendus autour de 40. Les mAs sont choisis afin d’avoir un maximum de détail mais sont également au plus bas possible. Le temps de prise doit être court afin d’éviter un flou cinétique, la contention étant le plus souvent compliquée sur ces petits patients. Des clichés du corps entier sont souvent réalisés afin d’éviter la multiplication des clichés.
Le cœur semble plus gros que chez l’adulte, les poumons ne sont pas complètement distendus et gonflés. Le pattern interstitiel est plus marqué que chez l’adulte en raison d’une rétention de liquide au sein du tissu interstitiel. Crânialement, le thorax est opacifié par le thymus et les muscles des membres antérieurs. Ceci ne doit pas être confondu avec une masse médiastinale. Le VHS (vertebral heart score) est de 11,5 corps vertébraux contre 7,5 +/- 0,3 chez le chien.
Le contraste abdominal est rendu faible par l’absence de graisse. Ceci ne doit pas être pris pour une péritonite ou un épanchement péritonéal Les gaz intestinaux sont bien visibles. Le volume du foie est subjectivement augmenté en raison de son rapport avec le reste du corps qui est plus important que chez l’animal adulte.
b) Échographie
L’animal est placé dans un doggy relax® ou maintenu par un aide. L’utilisation de gel et surtout de l’alcool est limitée car elle favorise le refroidissement. Tapis chauffant et warm touch sont sources d’interférences électriques.
La taille de la fenêtre intercostale rend quasi-illusoire toute échographie cardiaque.
L’examen de l’abdomen est réalisé à l’aide d’une sonde haute fréquence. Le foie est examiné sagittalement de droite à gauche. La vésicule est visualisée à droite. Une échogénicité normale du parenchyme hépatique permet de mettre en évidence les parois hyperéchogènes des vaisseaux porte et hépatiques. Les parois de la vésicule sont fines et le contenu anéchogène.
Le parenchyme splénique est hyperéchogène par rapport au foie. Puis le rein gauche est examiné en coupe transverse et longitudinale.
Les ganglions abdominaux sont physiologiquement de taille augmentée par rapport à l’adulte mais restent cependant d’échogénicité normale.
IV- Conclusion
Contrairement à d'autres mammifères, le chiot ou le chaton naissent à un stade très immature de leur développement. Ils bénéficient cependant d'une capacité d'adaptation et d'un potentiel de récupération remarquables. C'est pourquoi, face à une maladie, il est toujours intéressant de tenter un traitement, même si l’animal est très jeune.
Bibliographie
- Casal M. Management and critical care of the neonate. In: BSAVA Manual of canine and feline reproduction and neonatalogy. 2d ed. BSAVA Gloucester, 2010:pp135-146.
- Chastant-Maillard S, Aggouni C, Albaret A et coll. Canine and feline colostrum. Reprod Domest Anim. 2017;52 Suppl 2:148-152.
- Hoskins JD. Pediatrics: puppies and kittens. Pediadric health care and management. Vet Clin North Am Small Anim Pract.1999;29:837–844.
- Johnston SD, Root Kutritz MV, Olson PNS. Canine and Feline Theriogenology. 1st ed. Philadelphia, PA: Saunders; 2001:592pp.
- Lawler DF. Neonatal and pediatric care of the puppy and kitten. Theriogenology. 2008;70:384–392.
- Poffenbarger EM, Olson PN, Ralston SL, Chandler ML. Canine neonatalogy. Part I. Physiologic differences between puppies and adults. Compend Contin Educ Pract Vet. 1990;12:1601–1609.
- Rosset E, Buff S. Néonatalogie : conséquences diagnostiques et thérapeutiques. Numéro Spécial Point Vet. 2008;39:63-68.
- Rosset E, Rannou B, Casseleux G, Chalvet-Monfray K, Buff S. Age-related changes in biochemical and hematologic variables in Borzoi and Beagle puppies from birth to 8 weeks. Vet Clin Pathol. 2012; 41(2):272-82.
> La réanimation du nouveau-né : le score APGAR, l'indispensable pour évaluer le pronostic vital avant la sortie
Marcy L'etoile France
I- Introduction
Le score APGAR a été mis au point en médecine humaine par Virginia APGAR en 1952 pour évaluer la santé des nouveau-nés. La vitalité du nouveau-né est évaluée selon 5 paramètres.
- Apparence (coloration de la peau)
- Pouls (fréquence cardiaque)
- Grimace (réaction aux stimuli)
- Activité (tonus musculaire)
- Respiration (fréquence et efforts respiratoires)
Pour chaque paramètre une note est attribuée : 0 pour un résultat faible, 2 pour un bon résultat. La somme des notes donne le score APGAR et donne un aperçu de l’état de santé du nouveau-né et s’il a besoin de soins spécifiques. Plus le score est bas et plus le nouveau-né est en détresse. Un score entre 7 et 10 est considéré comme adéquat. Un score entre 4 et 6 est considéré comme bas, le nouveau-né nécessite une assistance. De 0 à 3 le nouveau-né est dans un état critique, il s’agit d’une urgence. En médecine humaine, le score APGAR est réalisé à 1 minute et 5 minutes suivant la naissance puis répété (toutes les 5/10/15/20 minutes, selon l’état du patient).
Le score APGAR a été adapté à l’espèce canine en 2009 par Veronesi et al. puis en 2010 par Groppetti et al. Il y a donc 2 grilles disponibles, la plus utilisée étant celle de Veronesi.
Après un rappel des mesures de réanimation néonatale chez le chiot, nous verrons en quoi consiste la méthode APGAR et comment réaliser un score APGAR dans l’espèce canine. Enfin, nous verrons quelles sont les intérêts et limites de cette méthode.
II- La réanimation du chiot nouveau-né
La réanimation commence par l’ouverture des annexes fœtales, pour permettre au chiot de respirer. Lors d’une césarienne, les annexes sont ouvertes rapidement et un clamp est posé sur le cordon ombilical. Lors d’une mise-bas naturelle, la mère s’occupe généralement de l’ouverture des annexes mais en cas d’échec il faut intervenir rapidement.
Il faut ensuite libérer les voies aériennes : les sécrétions qui sont sur la bouche et les narines du chiot sont enlevées à l’aide de compresses ou avec la serviette qui sert à sécher le chiot. A l’aide d’un mouche bébé, les narines et la bouche sont aspirées. L’aspiration au mouche-bébé est préférable à l’aspiration à la seringue. Dans un article de 2012 qui compare ces deux méthodes en termes d’aspect pratique (a-t-il été possible d’appliquer la méthode ?), d’efficacité (des fluides ont-ils été aspirés ?) et de sécurité (présence de sang au niveau des narines), l’aspiration avec un mouche-bébé était supérieure à l’aspiration avec une seringue. L’aspiration ne doit pas être trop forte afin de ne pas entrainer un spasme du larynx. Bien que décrit autrefois, il est maintenant admis qu’il ne faut pas secouer le chiot (mouvement de balancier) car cela peut provoquer des hémorrhagies cérébrales. Une fois les voies aériennes libérées, il faut stimuler la respiration du nouveau-né en le frottant énergiquement à l’aide d’une serviette propre, surtout sur le thorax. La tête du chiot doit être inclinée vers le bas afin de favoriser l’élimination des sécrétions. C’est lors de cette étape que le chiot commence à respirer, à couiner et devient rose. Il faut continuer à aspirer les sécrétions (toutes les 5 minutes environ) et le sécher entièrement. Cela limite les risques l’hypothermie. En cas de difficultés respiratoires, il faut mettre le chiot sous oxygène à l’aide d’un masque. La respiration peut également être stimulée à l’aide d’un point d’acupuncture : le point de Jen Chung (GV26), situé à la base du philtrum nasal. Une aiguille 25G est enfoncée jusqu’à entrer en contact avec l’os, puis tournée légèrement. L’utilisation de Doxapram est déconseillée car cela diminue le débit sanguin cérébral et augmente la consommation et les besoins en oxygène du cerveau.
Une fois que le chiot est stable, une ligature est placée sur le cordon ombilical, entre le clamp et le chiot. Les annexes sont coupées et le moignon est désinfecté à l’aide de chlorhexidine.
Le chiot ne sait pas réguler sa température quand il nait. Il doit être placé dans un environnement chaud, avec les autres de la portée, idéalement dans une couveuse à 30°C, sinon dans une caisse avec un tapis chauffant, des bouillottes, des couvertures… tout en faisant attention aux brûlures. Le sèche-cheveux doit être évité (risque de brûlures et de déshydratation).
L’étape de vérification des malformations doit être faite le plus tôt possible. En effet si un chiot présente une malformation, selon sa gravité il est préférable de ne pas le réanimer/stopper la réanimation, plutôt que de l’euthanasier une fois réanimé. Pour la fente palatine, l’idéal est de le faire au moment de l’aspiration des sécrétions dans la bouche. Il faut regarder également au niveau du périnée si le chiot a bien un anus (risque d’imperforation anale). Les autres malformations sont évidentes : anasarque, hydrocéphalie, hernie abdominale, anomalie des membres …
Le chiot étant réanimé, il est identifié (collier de différentes couleurs). L’examen du chiot comprend le score APGAR (à 5 puis 60 minutes), la prise du poids et de la température.
III- La méthode APGAR chez le chiot
En 2009, l’équipe du Dr Veronesi réalise une étude dans laquelle un score APGAR est établi sur 166 chiots à 5 minutes post-naissance. La survie des chiots à 2 heures (vivant/mort) et à 24 heures est évaluée. Des différences significatives en termes de survie entre les groupes de score d'Apgar sont mises en évidence.
La grille APGAR utilisée est représentée dans la figure 1.
- L’Apparence a été évaluée par la couleur des muqueuses.
- Le Pouls, se réfère à la fréquence cardiaque.
- La Grimace, indique la réaction du nouveau-né à l’irritabilité.
- L’Activité a été évaluée par le tonus musculaire/ la mobilité du nouveau-né.
- La Respiration a été évaluée avec la fréquence respiratoire et les vocalises du chiot.
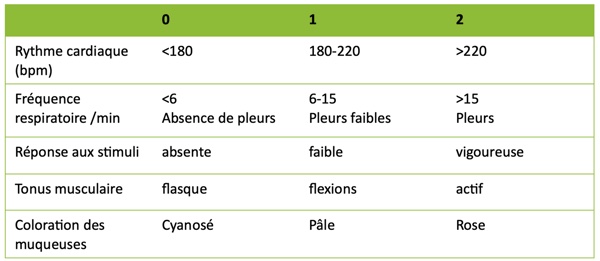
Figure 1
Un score APGAR entre 0 et 3 indique une détresse sévère, un score entre 4 et 6 indique une détresse modérée et un score entre 10 et 14, une absence de détresse.
En 2010, l’équipe du Dr Groppetti publie un article avec une grille APGAR différente. Deux paramètres sont ajoutés : les vocalises du chiots (absentes, faibles, fortes) et le réflexe de succion (absent, faible, fort). Le score s’étend de 0 à 14 : un score de 0 à 4 indique une détresse sévère, un score de 5 à 9 une détresse modérée et un score de 10 à 14, une absence de détresse.
IV- Le score APGAR en pratique
La mesure de la fréquence cardiaque se fait à l’aide d’un stéthoscope (idéalement un stéthoscope pédiatrique).
L’évaluation de la respiration se fait en comptant les mouvements respiratoires mais en prenant compte aussi des vocalises du chiot (souvent associés).
La réponse au stimuli ou irritabilité réflexe est évaluée par la compression douce de l'extrémité d'une patte, évaluant le degré de réaction du nouveau-né :
- les pleurs et la rétraction rapide de la patte sont notés 2,
- la rétraction faible de la patte et l'absence de vocalisation ou une faible vocalisation sont notées 1,
- l'absence de rétraction de la patte et l'absence de vocalisation sont notées 0.
Le tonus musculaire ou mobilité s’évalue en observant la force des mouvements spontanés du nouveau-né : 2 si forts, 1 si légers et 0 si absents ou faibles.
La couleur des muqueuses s’évalue au niveau du museau. Des muqueuses cyanosées indiquent une insuffisance respiratoire aiguë (score 0), des muqueuses roses une activité respiratoire adéquate (score 2).
Enfin, on additionne les notes obtenues pour obtenir le score APGAR final. Le score est fait à 5 minutes et à 60 minutes.
V- Particularités des races brachycéphales
Dans l’étude de Batista et al. réalisée en 2014 chez le Bulldog anglais et le Bouledogue français, le score AGPAR a été adapté aux races brachycéphales.
Les légères variations incluent une fréquence cardiaque inférieure considérée comme normale : une fréquence cardiaque supérieure à 180 battements par minute était notée 2, entre 120 et 180 battements par minute notée 1 et inférieure à 120 battements par minute notée 0. La respiration est évaluée en tenant compte uniquement de la fréquence respiratoire. La couleur des muqueuses est évaluée à 2 si rouge, à 1 si rose et à zéro si cyanotique ou pâle.
VI- Intérêts du score APGAR
Le score APGAR permet d’évaluer la vitalité du chiot. L’identification précoce des nouveau-nés à risque est essentielle pour minimiser les pertes. Ainsi, si un chiot présente un score bas, un suivi et des soins adaptés peuvent être mis en place rapidement. Le suivi APGAR (évaluations répétées) des chiots permet d’évaluer la réponse du chiot à la réanimation donc indirectement, de contrôler de l’efficacité des mesures de réanimation.
En 2017, l’équipe de Néocare (Toulouse) a réalisé une étude sur 347 chiots. Le but était d’identifier des facteurs prédictifs de la mortalité néonatale (soit dans les 3 premières semaines de vie). L’un des facteurs étudiés était le score APGAR, réalisé dans les 8 premières heures de vie. Cette étude a mis en évidence une relation entre le score APGAR et les chances de survie du chiot durant les 24 premières heures. Les chiots présentant un score <7 avaient un risque de mortalité significativement plus important que les autres. Ainsi, le taux de mortalité était de 1% chez les chiots avec un score supérieur à 7 et à 22% chez les chiots avec un score <7. En revanche, la relation entre score APGAR et les chances de survie du chiot durant les 3 premières semaines est moins évidente. En conclusion, le score APGAR permet d’évaluer le risque de mortalité à court terme (au cours des 24 premières heures) mais pas à long terme.
La méthode APGAR présente des limites : Il faut rappeler qu’un score APGAR élevé n’est pas une garantie de survie. Un score APGAR est valable à un instant T, peut varier en fonction de l’opérateur et de la race. Parmi les facteurs de variations, le contexte de la naissance a également une influence sur le score APGAR. Enfin, si le score APGAR permet d’identifier les chiots à risque, il ne donne pas d’indication sur les mesures à entreprendre, ni sur le diagnostic.
VII- Conclusion
La méthode APGAR est simple (peu de paramètres à évaluer, ne requiert pas de compétences spécifiques), rapide, peu couteuse, pratique et ne demande pas beaucoup de matériel (un stéthoscope).Malgré certaines limites qu’il convient de prendre en compte, le score APGAR et son suivi sont des bons outils pour évaluer l’état de santé d’un nouveau-né et pour identifier les chiots à risque.
Bibliographie
- Veronesi MC. Assessment of canine neonatal viability-the Apgar score. Reprod Domest Anim Zuchthyg. sept 2016;51 Suppl 1:
- Veronesi MC, Panzani S, Faustini M, Rota A. An Apgar scoring system for routine assessment of newborn puppy viability and short-term survival prognosis. Theriogenology. août 2009;72(3):40
- Groppetti D, Pecile A, Del Carro AP, Copley K, Minero M, Cremonesi F. Evaluation of newborn canine viability by means of umbilical vein lactate measurement, apgar score and uterine tocodynamometry. Theriogenology. 15 oct 2010;74(7):11
- Mila H, Grellet A, Delebarre M, Mariani C, Feugier A, Chastant-Maillard S. Monitoring of the newborn dog and prediction of neonatal mortality. Prev Vet Med. 1 août 2017;143:
- Batista M, Moreno C, Vilar J, Golding M, Brito C, Santana M, et al. Neonatal viability evaluation by Apgar score in puppies delivered by cesarean section in two brachycephalic breeds (English and French bulldog). Anim Reprod Sci. mai 2014;146(4):2
> Le syndrome du lait toxique existe-t-il vraiment ?
Maisons-Alfort France
Le syndrome du lait toxique désigne une affection des nouveau-nés, où le lait maternel serait responsable de troubles digestifs, voire de la mort d’un ou plusieurs individus de la portée. Ce syndrome est principalement (voire uniquement) décrit chez la chienne. La « toxicité » du lait maternel est attribuée à une contamination bactérienne ou par des toxines bactériennes, qui passent donc de la mère aux chiots. En cela, ce syndrome est donc une septicémie, affection classique du chiot nouveau-né, dans laquelle l’origine des bactéries est potentiellement diverse, allant de sources maternelles (peau, salive, fèces, secrétions vaginales) à des sources environnementales, avec des voies de contamination possiblement également variées (voie orale, nasale, ombilicale). La question de la responsabilité du lait dans la contamination des nouveau-nés mérite donc d’être posée.
Les secrétions lactées sont-elles stériles ?
Chez 90% des chiennes ne présentant aucun signe d’inflammation mammaire clinique, colostrum et lait contiennent de nombreuses souches bactériennes, principalement Staphylococcus (intermedius, pseudintermedius, epidermidis),, Enterococcus, Streptococcus, Bacillus, Clostridium, E. coli. Comme la plupart des autres organes, les secrétions lactées hébergent un microbiote qui leur est propre. L’identification de bactéries dans un échantillon de lait ne peut donc pas être utilisé comme un diagnostic de mammite. En cas de mammites cliniques, les secrétions lactées contiennent des charges bactériennes bien supérieures, avec la dominance d’une ou deux souches bactériennes. Par comparaison à d’autres espèces, notamment ruminants, la notion de mammite subclinique n’est pas définie chez la chienne : il s’agirait de cas où une ou deux souches bactériennes prédominantes seraient cultivées à partir des secrétions mammaires, mais en l’absence de signes généraux ou locaux et en présence avec une concentration en leucocytes (comptage cellulaire somatique) anormalement élevé : la question est alors de choisir comment on détermine le seuil de la normalité. Il pourrait l’être en examinant l’impact sur l’état de santé ou sur la croissance de chiots consommant du lait avec des taux cellulaires connus, mais la principale difficulté dans l’espèce canine est que les chiots consomment les secrétions de plusieurs mamelles. Vasiu et al (2021) ont proposé une définition de la mammite subclinique sur la base de signes cytologiques (présence de cellules inflammatoires, images de phagocytose bactérienne) et biochimiques (lait alcalin, augmentation de la concentration en protéine C dans le lait et le sang) mais sans évaluer le lien avec la santé des nouveau-nés.
D’où viennent ces bactéries lactées ?
En cas de mammite clinique, les bactéries se multiplient dans le tissu et dans la lumière mammaires. Lorsque la mamelle est (cliniquement) saine, les bactéries du lait proviennent probablement essentiellement de l’intestin de la mère (axe dit « entéromammaire »). Une contamination par voie ascendante (via les canaux lactéaux) existe également. Lorsqu’il existe un foyer infectieux (et s’agissant d’une femelle qui a mis-bas récemment, d’une métrite), les bactéries se multipliant dans ce foyer rejoignent la circulation sanguine, créant une bactériémie responsable des signes généraux développés le cas échéant par la mère ; les bactéries, comme d’autres composants sanguins participant à la composition du lait, peuvent ensuite être excrétées par le lait.
Le syndrome du lait toxique apparaissant dans les 10 premiers jours de vie et parfois dès les 2 premiers jours, est-il possible de conclure que le colostrum/lait soit la cause de la contamination ?
Non dans la mesure où le méconium n’est déjà pas lui-même stérile, indiquant bien l’existence d’une translocation (physiologique) de bactéries de la mère vers le fœtus (probablement de l’intestin de la mère vers le fœtus par voie transplacentaire). De plus, les nouveau-nés sont particulièrement sensibles au développement bactérien : leur physiologie particulière les prédispose à l’hypothermie, l’hypoglycémie, la déshydratation, 3 facteurs défavorables à l’activité phagocytaire ; d’autre part, les vaisseaux ombilicaux représentent dès la naissance une voie directe entre l’environnement et la circulation générale. Un développement bactérien précoce peut donc avoir une origine environnementale.
Si les mêmes souches bactériennes sont identifiées dans le lait et après analyse bactériologique de la rate de chiots morts, est-il possible de conclure à la responsabilité du lait dans la transmission de ces bactéries ?
Ce serait un élément de suspicion mais pas de démonstration. Il est tout à fait possible de penser que les mêmes bactéries retrouvées dans le lait et les chiots aient simplement la même origine. Par exemple que les chiots aient été contaminés par les fèces maternels et que le fameux axe entéromammaire soit responsable du fait qu’on le retrouve dans le lait. D’ailleurs une étude menée sur des chiots morts d’une infection néonatale par E. coli, les souches n’étaient communes entre le lait et les chiots que chez une chienne sur 10 (Münnich et Lübke-Becker, 2004). Schäfer-Somi et al 2003 ont aussi retrouvé les mêmes genres bactériens dans le lait et chez des chiots morts chez seulement 4 chiots morts sur 33.
Si les chiots sont retirés de leur mère dès qu’ils commencent à présenter des symptômes (douleur abdominale, diarrhée, voire des cas de mortalité dans la portée), et nourris avec du lait maternisé, la situation s’améliore. C’est bien une preuve que le syndrome du lait toxique existe.
Oui à condition qu’aucun antibiotique ne leur soit administré simultanément. Or cette précaution parait utile (et est souvent prise, avec raison), compte-tenu de la rapidité d’évolution des symptômes vers la mort chez les chiots nouveau-nés.
Conclusion
Dans l’état actuel des connaissances, il semble donc que le lait ne soit pas une voie fréquente de contamination bactérienne chez le chiot en dehors des cas de mammite clinique.
Bibliographie
- Münnich A, Lübke-Becker A. Theriogenology, 2004, 62, 562-575
- Vasiu I et al. Animals, 2021, 11, 3259
- Schäfer-Somi S et al. J Vet Med B. 50, 343-346
> Que faire en cas de réanimation néonatale difficile?
Maisons-Alfort France
I- Introduction
Dans les quelques secondes qui suivent son expulsion par voie vaginale ou son extraction hors de l’utérus lors de césarienne, le nouveau-né débute des mouvements respiratoires. Or cette induction de la respiration est parfois plus longue à obtenir. C’est alors que sont engagées des manœuvres de réanimation néonatale. L’objectif de cet article est de proposer tout d’abord des conditions pratiques de réanimation qui vont limiter le risque de se trouver face à une réanimation « difficile », i.e. des nouveau-nés chez lesquels une respiration efficace met plusieurs dizaines de minutes à être obtenue. Puis quelques stratégies de dernier recours seront proposées.
II- La réanimation néonatale classique
Les gestes de base pour réanimer un nouveau-né carnivore sont
1. Dégager les voies respiratoires
- En tenant le nouveau-né dans le creux de sa main, la tête vers le bas.
- En aspirant à l’aide d’un mouche-bébé le liquide amniotique présent dans la bouche essentiellement et secondairement dans la cavité nasale (l’efficacité de l’aspiration étant limitée par le diamètre des naseaux).
2. Déclencher la respiration
Par la friction du thorax en partant de l’hypochondre vers l’entrée du thorax (ce qui contribue également à dégager les voies respiratoires)
III- Comment améliorer l’efficacité des premiers gestes de réanimation néonatale
1. Les gestes moins connus À FAIRE
- Laisser en contact avec le placenta jusqu’à ce que la respiration soit obtenue.
- Effectuer les manœuvres de réanimation en zone chaude, par exemple un matelas à air chaud et non pas sur une table d’examen froide.
- Si un morphinique est administré au cours de la prise en charge anesthésique de la mère, l’administration de naloxone au nouveau-né permet d’en antagoniser l’effet : après aspiration d’un éventuel résidu de liquide amniotique dans la cavité buccale, une goutte de NARCANND (solution de naloxone à 0,4 mg/ml) est administrée sous la langue du nouveau-né, puis la bouche est maintenue fermée pendant 30 secondes. On enfreint donc l’ordre de la règle ABCD (Airways, Breathing, Circulation, Drugs), en administrant une « drogue » dès le début du process de réanimation. L’administration peut être renouvelée..
- Effectuer la friction thoracique en exerçant une compression thoracique (physiologiquement, c’est cette compression thoracique au passage de la filière pelvienne qui déclenche la levée de l’inhibition du centre respiratoire bulbaire). Cette friction thoracique peut/doit être énergique.
2. Les gestes À NE PAS FAIRE
- Ne pas injecter de médicaments qui viseraient à augmenter la fréquence cardiaque. La bradycardie est un mode de protection normal et salutaire du nouveau-né qui ne respire pas face à l’hypoxie : les besoins en oxygène sont ainsi diminués par cette bradycardie et la circulation est réorientée vers le cerveau et la vascularisation du muscle cardiaque.
- Ne pas balancer le nouveau-né ou le secouer avec la tête en bas : si ces gestes sont extrêmement efficaces pour évacuer le contenu liquidien des voies respiratoires, ils provoquent des lésions hémorragiques intra-cérébrales ou sous-méningées susceptibles d’entrainer la mort à plus ou moins long terme.
IV- Que faire si les premiers gestes de réanimation restent inefficaces?
- Continuer (aspiration des liquides dans les voies respiratoires et dans la cavité buccale / administration de naloxone sublinguale / friction). La durée au bout de laquelle la situation peut être considérée comme désespérée est difficile à préciser. Un nouveau-né est capable de rester en hypoxie/anoxie pendant probablement près d’une heure. Une question non résolue est de savoir quelles sont les conséquences à moyen et long terme d’une réanimation longue. Chez le veau et le poulain, les anoxies néonatales longues se traduisent souvent par de la mortalité néonatale et/ou une incapacité à téter efficacement.
- Exercer un stimulus douloureux :
- par des pichenettes sur tout le corps (sur un nouveau-né en décubitus latéral);
- en pinçant avec tous les ongles d’une main la ligne du dos;
- Introduire une aiguille (orange 25 G ou bleue 23G) à la base du philtrum nasal (à la base de la truffe) sur la ligne médiane de l’animal jusqu’à l’os nasal. Ce point est réputé être un point d’acupuncture (GV26) mais il peut s’agir également d’un stimulus douloureux;.
- placer la tête du nouveau-né dans un flux d’oxygène (par exemple en lui plaçant la tête dans un masque, même si pas pédiatrique) de façon à optimiser l’hématose des moindres mouvements respiratoires même superficiels;.
- augmenter la capacité de dégagement des voies respiratoires et déplier les alvéoles pulmonaires à l’aide d’une pompe One Puff;
- en dernier recours, tenter une intubation trachéale à l’aide d’un otoscope et d’une sonde urinaire féline (6 Fr) ou d’un cathéter intraveineux (12G);
- en cas d’arrêt cardiaque (consécutif en général à un échec prolongé de la réanimation respiratoire), l’administration intracardiaque d’adrénaline (0,1 mg/kg) peut être tentée, ainsi qu’un massage cardiaque (par compression du thorax entre deux doigts) mais avec un faible espoir de réussite.
Conclusion
Une réanimation néonatale efficace est une affaire d’équipe : une procédure standardisée et une formation des ASV est un atout crucial.
À la suite d’une mise-bas supervisée par une équipe vétérinaire, la prise en charge des nouveau-nés ne s’arrête pas à l’induction d’une respiration efficace : s’agissant d’optimiser le taux de survie, la gestion de la première tétée sera idéalement gérée à la clinique afin d’assurer une prise colostrale précoce (sauf dans les cas où le propriétaire possède l’expérience nécessaire pour la gérer seul à la maison). En aucun cas, les nouveau-nés ne seront laissés seuls avec leur mère en raison des risques d’écrasement et de cannibalisme : chaque nouveau-né sera mis à la mamelle sous surveillance et avec une contention adaptée de la mère.
Bibliographie
- Wilborn R. Small Animal neonatal health. Vet Clin North Am Small Anim Pract. 2018;48(4):683-699.
