> Massage/réanimation cardiopulmonaire du nouveau-né
Montpellier France
I- Introduction
La période néonatale peut être définie comme les 2 premières semaines de la vie post-partum.
Il y a très peu d'études récentes sur la réanimation des nouveau-nés. En 2012, les recommandations RECOVER ont été publiées pour la réanimation des chats et chiens mais aucune recommandation n'avait été faite pour les nouveau-nés. Nous avons la chance que ces recommandations RECOVER aient été réevaluées très récemment et ont cette fois ci dédié une partie aux nouveau-nés. Cela n'est pas encore publié, elles le seront bientôt mais Dan Fletcher, au dernier congrès européen EVECC, a présenté le préambule de ce consensus.
II- Généralités
Les taux de mortalité dans la population de patients nouveau-nés varient de 9 à 26 %, la majorité des décès survenant dans les trois premiers jours après la naissance. Les causes comprennent :
- les malformations congénitales ;
- le faible poids à la naissance ;
- l'hypoxie ;
- les traumatismes lors de l'accouchement ;
- une mauvaise nutrition ;
- de mauvais soins prénatals de la mère ;
- un mauvais maternage ;
- une infection et un stress environnemental.
Il est important d’évaluer les nouveau-nés grace au score de APGAR pour avoir un ordre d'idee de la chance de survie des petits les plus faibles :
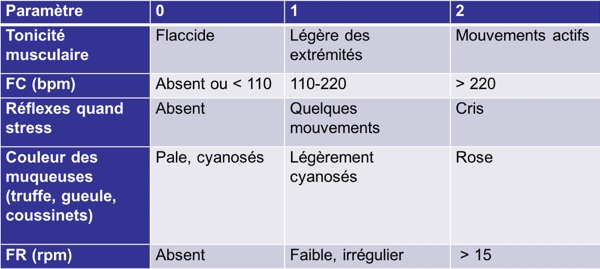
Figure 1
Un score <6 a la naissance : faible probabilité de survie à 24h post-naissance
Les causes les plus fréquentes de dépression néonatale à la naissance sont les déficiences/insuffisances liées aux médicaments utilisés pendant la césarienne et l'hypoxie. Chaque médicament utilisé dans le protocole anesthésique et analgésique d'une césarienne présente des avantages et des inconvénients. Tout médicament administré, qu'il soit inhalé ou injectable, a le potentiel d'atteindre les jeunes à travers le placenta.
Une intervention pour la réanimation des nouveau-nés après une mise bas « normale » doit avoir lieu :
- si les actions d'une mère ne parviennent pas à stimuler respiration, vocalisation et mouvement dans la minute suivant la naissance ;
- si la dystocie a contribué à un mauvais état post-partum des nouveau-nés ou de la mère.
III- Mise en oeuve
La réanimation néonatale optimale après la naissance (si la mère ne le fait pas) ou la césarienne implique les mêmes principes ABC. La respiration spontanée et la vocalisation à la naissance sont positivement associées à la survie jusqu'à l'âge de 7 jours. Les nouveau-nés anesthésiés par césarienne n'initient souvent pas la respiration spontanément. Tout d'abord, il faut procéder à un dégagement rapide des voies respiratoires en retirant les membranes fœtales du visage, suivi d'une aspiration douce avec une seringue à poire ou un aspirateur. L'évacuation des fluides des voies respiratoires est facilitée par l'abaissement de la tête du nouveau-né sous le thorax. Un séchage doux mais rapide et une stimulation du nouveau-né avec une petite serviette chaude pour favoriser la respiration et éviter le refroidissement sont effectués. Les nouveau-nés ne doivent pas être balancés pour dégager les voies respiratoires en raison du risque d'hémorragie cérébrale due à une commotion cérébrale. L'utilisation du doxapram comme stimulant respiratoire est peu susceptible d'améliorer l'hypoxémie associée à l'hypoventilation et n'est pas recommandée.
La réanimation cardiorespiratoire pour les nouveau-nés qui ne respirent pas spontanément est difficile mais potentiellement gratifiante. Si l’élimination des membranes fœtales et le séchage à la serviette n'ont pas produit une respiration efficace, l'assistance ventilatoire doit inclure l'apport d'oxygène à débit constant par masque facial. Si cela est inefficace après 1 minute, une pression positive avec un masque bien ajusté doit être lancée pour essayer de gonfler efficacement les poumons.
L'intubation endotrachéale (à l'aide d'un tube endotrachéal de 2 mm ou d'un cathéter intraveineux de calibre 12 à 16) est réalisable mais techniquement plus difficile en raison de la taille et de la fragilité du patient et présente un plus grand potentiel de traumatisme des voies respiratoires supérieures ; 30 à 40 respirations par minute, avec une FIO2 inférieure à 40% à 60% et une pression d'environ 10 cm H2O, sont conseillées. Une assistance ventilatoire efficace provoque l'expansion du thorax, indiquant une inflation pulmonaire. Une insufflation excessive peut provoquer une aérophagie. Le succès de la stimulation de la respiration avec la stimulation du point d'acupuncture Jen Chung (GV 26) est possible : une aiguille de petit calibre ou d'acupuncture est insérée dans le philtrum nasal à la base des narines et tournée lorsque le cartilage/l'os est en contact. Le séchage du museau + le Jen Chung stimulent les neurorécepteurs respiratoires présents dans le museau et fonctionnels à la naissance.
La stimulation cardiaque doit suivre l'assistance ventilatoire. L'hypoxémie myocardique est la cause la plus fréquente de bradycardie ou d'asystolie chez le nouveau-né. Si la FC est <50 bpm malgré les mesures déjà prises, les compressions cardiaques doivent suivre les recommandation suivantes : 120 - 150 bpm. Il n'y a pas pour le moment de consensus ni pour la position ni pour la technique du massage cardiaque :
- Si la bradycardie persiste malgré le dégagement des voies respiratoires et la ventilation, des compressions cardiaques transthoraciques directes sont conseillées en premier lieu ;
- L’adrénaline est le médicament de choix en cas d'arrêt/arrêt cardiaque (10–200 mg/kg ou 0,01–0,20 mg/g) administré de préférence par voie intraveineuse ou intraosseuse). La posologie intratrachéale n'est probablement pas efficace chez le nouveau-né et la ponction intracardiaque est traumatisante. L'adrénaline doit être fraîchement diluée pour la réanimation néonatale afin de permettre un dosage précis. L'accès veineux chez le nouveau-né est difficile; la veine ombilicale est une possibilité si pas thrombosée ; sinon, une veine céphalique ou jugulaire peut être cathétérisée si des fluides ou une thérapie sont souhaités. L'humérus proximal, le fémur proximal et le tibia proximal offrent de meilleurs sites intra-osseux pour l'administration de médicaments. La circulation doit être présente pour la distribution des médicaments ; le massage cardiaque doit se poursuivre après l'administration jusqu'à ce qu'un battement cardiaque soit détectable. L'atropine est actuellement déconseillée en réanimation néonatale. Le mécanisme de la bradycardie est la dépression myocardique induite par l'hypoxémie plutôt que la médiation vagale, et la tachycardie induite par les anticholinergiques peut en fait exacerber les déficits en oxygène du myocarde.
IV- Au-delà de l'abc
Lorsque les nouveau-nés ne répondent pas à la réanimation de base, les facteurs contributifs doivent être pris en compte. Les nouveau-nés refroidis peuvent ne pas répondre à la réanimation. La perte de température corporelle se produit rapidement lorsqu'un nouveau-né est humide. Il est important de garder les nouveau-nés au chaud pendant la réanimation et dans la période post-partum immédiate. Pendant la réanimation, placer le corps d'un nouveau-né dans un bain d'eau chaude peut améliorer la température centrale. Les compressions thoraciques et l'oxygénation par masque facial peuvent se poursuivre pendant qu'un nouveau-né est dans le bain-marie. Travailler sous une lampe chauffante ou un dispositif de réchauffement Bair Hugger est utile pour gérer le refroidissement pendant la réanimation. Après la réanimation, les nouveau-nés doivent être placés dans une boite chaude avec des serviettes chaudes jusqu'à ce qu'ils puissent être laissés en toute sécurité avec leur mère.
L'hypoglycémie entraîne également une mauvaise réponse à la réanimation. Les nouveau-nés manquent de réserves de glucose et ont une capacité minimale de gluconéogenèse. Fournir de l'énergie lors d'efforts de réanimation prolongés devient critique. L'hypoglycémie clinique (souvent inférieurs à 30 à 40 mg/dL) et peut être traitée avec une solution de dextrose, administrée soit par voie intraveineuse/intra-osseuse, à une dose de 0,5 à 1,0 g/kg de poids corporel en utilisant une solution de dextrose à 5 % à 10 %, ou à une dose de 2 à 4 mL/kg de poids corporel d'une solution de dextrose à 10 %. L'accès veineux est difficile chez les tout petits nouveau-nés. L'administration sous-cutanée n'est pas souhaitable en raison du risque d'abcès. La solution de dextrose à 50 % ne doit être appliquée que sur les muqueuses en raison du risque de phlébite si elle est administrée par voie intraveineuse ; cependant, la circulation doit être adéquate pour l'absorption par la muqueuse ou le tractus gastro-intestinal, et il existe un risque d'aspiration. Les nouveau-nés ayant reçu plusieurs doses de dextrose doivent être surveillés pour détecter une hyperglycémie en raison de mécanismes de régulation métabolique immatures. Si un nouveau-né est trop faible pour téter, un mélange d'une solution saline réchauffée et équilibrée avec du dextrose à 2,5 % (afin de ne pas être hypertonique) peut être administré par sonde orogastrique à une dose de 0,1 à 0,5 mL par 30 g de poids corporel, jusqu'à ce que le chiot puisse être nourri ou allaité. Une solution équilibrée et chauffée de dextrose et d'électrolyte peut être administrée par voie orale par sonde gastrique toutes les 15 à 30 minutes jusqu'à ce que le nouveau-né soit capable de téter bien que l'acquisition de colostrum soit supérieure à cette fin.
V- Quand arrêter la réanimation
- Absence de réponse après 15 à 20 minutes d'efforts (respiration agonique continue ou bradycardie) ;
- Malformation congénitale grave détectée (fente palatine, souffle bruyant, gastroschisis, gros omphalocèle, grosse fontanelle, anasarque ou malformation anogénitale).
Bibliographie
- Benita von Dehn. Pediatrics physiology VCNA 2014
- Sophie Grundy. Clinically relevant physiology in neonates. Vet Clin Small Anim 2006
- Davidson A. Neonatal resuscitation, improving the outcome. VCNA 44 (2014) 191-204.
- Moon P. Neonatal critical care. Clinical theriogenology 31 (2001)
- Lee J. , Cohn L. Fluid therapy for pediatric patients. VCNA 47 (2017) 373-382
- McMichael M. Critically ill neonats and pediatric patients. SCCM book. Chapter 155.
> POCUS : particularités
Meaux France
I- L’échographie thoracique
La technique TFAST (Thoracic Focused Assessment with Sonography for Trauma) a été décrite en 2008. Cette technique échographique permet de diagnostiquer rapidement un pneumothorax, un épanchement pleural, un épanchement péricardique ainsi que des lésions pulmonaires associées avec d’excellentes sensibilité et spécificité (1).
L’échographie est effectuée sur des animaux qui ne sont pas tondus. De l’alcool est utilisé pour humidifier les poils. Le patient est placé en décubitus latéral. La sonde échographique est posée en regard des sites d’insertion d’éventuels drains thoraciques (7-9èmes espaces intercostaux) ainsi qu’en regard de l’apex du cœur (en arrière du coude), alternativement de chaque côté du patient, puis en région diaphragmatique.
En l’absence de lésion échographique, les images suivantes sont visualisées :
- les côtes produisent un cône d’ombre propre ;
- la plèvre est à l’origine d’une image dont l’interface est hyperéchogène. Un glissement de la plèvre (glide) est identifié lors des mouvements respiratoires ;
- le parenchyme pulmonaire est visible, distalement à la plèvre. Il apparait hétérogène et des interfaces hyperéchogènes sont présentes.
Lorsque des lésions pulmonaires interstitielles sont présentes, les images suivantes sont visualisées :
- les côtes produisent un cône d’ombre propre ;
- la plèvre est à l’origine d’une image dont l’interface est hyperéchogène. Un glissement de la plèvre (glide) est identifié lors des mouvements respiratoires ;
- le parenchyme pulmonaire est visible, distalement à la plèvre ;
- des images de « roquettes pulmonaires » ou « B lines » sont visibles. Il s’agit d’images hyperéchogènes qui débutent à l’interface pleurale et s’étendent distalement, sur l’ensemble de l’image. Ces « roquettes pulmonaires » ont le même mouvement de glissement que la plèvre.
Lors de pneumothorax, fracture de côte, contusion pulmonaire ou hernie diaphragmatique, une image de « marche d’escalier » peut en être un signe indirect.
Les côtes produisent un cône d’ombre propre. La plèvre est à l’origine d’une image dont l’interface est hyperéchogène. Un glissement de la plèvre (glide) est identifié lors des mouvements respiratoires. Cependant, une discontinuité de l’interface hyperéchogène de la plèvre est présente.
Lors de pneumothorax, les mouvements de la plèvre sont absents.
Les côtes produisent un cône d’ombre propre. La plèvre est à l’origine d’une image dont l’interface est hyperéchogène. Il n’y a pas de glissement de la plèvre (glide) lors des mouvements respiratoires. Les images du parenchyme pulmonaire peuvent être normales ou anormales.
La technique TFAST peut être répétée à intervalles réguliers afin de suivre l’évolution de lésions thoraciques.
II- Échographie abdominale
Une équipe a mis en évidence sur 235 chiens victimes d’un accident de la voie publique que 20.4% présentaient plusieurs traumatismes localisés au thorax et à l’abdomen (5). Il peut être recommandé d’effectuer un bilan lésionnel abdominal sur tous les patients admis en urgence.
La technique AFAST (Abdominal Focused Assessment with Sonography for Trauma) a été décrite en 2004. Cette technique échographique permet de diagnostiquer rapidement un épanchement abdominal avec d’excellentes sensibilité et spécificité (1).
L’échographie est effectuée sur des animaux qui ne sont pas tondus. De l’alcool est utilisé pour humidifier les poils. Le patient est placé en décubitus latéral droit. La sonde échographique est posée en regard de 4 sites : en regard de la vessie, du rein gauche, en arrière de la 13ème sternèbre et en regard du rein droit.
III- Conclusion
Le bilan lésionnel des patients admis dans un service d’urgences fait intervenir l’échographie. L’un des avantages des techniques TFAST et AFAST réside dans le fait qu’il s’agit de techniques rapides qui peuvent être intégrées à une prise en charge horizontale du patient.
