> Radiographie osseuse : particularités du jeune - Anomalie acquise (fracture/ infection)
Vélizy-Villacoublay
I- Rappels de technique radiographique [1]
Comme pour tout examen radiographique, l’obtention d’images en projection sur un plan de la région examinée impose d’avoir recours à au moins deux incidences orthogonales afin de pouvoir appréhender les 3 dimensions des structures observées.
La radiologie numérique offre aujourd’hui une latitude d’exposition beaucoup plus grande que les films argentiques, tolérant des erreurs d’exposition assez importantes. Cependant, il faut veiller à :
- Utiliser un algorithme de reconstruction adapté ;
- Ne pas sous-exposer ou surexposer le cliché ;
- Respecter un positionnement, un centrage et un cadrage parfaits de la zone à radiographier.
De même, afin de respecter les règles de radioprotection et de remplir les conditions techniques d’obtention des clichés radiographiques osseux de bonne qualité (temps de pause long, kilovoltage peu élevé, positionnement contraignant et parfois douloureux), le recours à une sédation forte voire à une anesthésie générale est indispensable, en dehors d’une situation post-traumatique immédiate où le cliché aura comme seul objet de confirmer une fracture majeure et manifeste (cliché dit de « débroussaillage »), situation dans laquelle un cliché unique même de qualité moyenne sera suffisant.
Lors de fractures de zones complexes, comme dans la région du tarse ou du carpe, un examen scanner peut être conseillé pour préciser le nombre et la position des fractures, ainsi que les déplacements osseux à prendre en compte dans le traitement chirurgical ou conservateur.
II- Particularités anatomiques du jeune en croissance, appliquées à la radiographie [2]
1. Métaphyse
Chez le jeune, les métaphyses restent radiotransparentes car de nature cartilagineuse. Il est important d’en connaître la position anatomique ainsi que l’âge normal de fermeture pour l’espèce et la race concernées, afin notamment de ne pas les confondre avec une ligne de fracture. De nombreuses références bibliographiques existent et fournissent ces données (référence [2] p.88). Il est important de s’y référer afin d’en connaître la position, l’aspect, et les dates de fermeture. Lors d’un traumatisme, une fracture peut concerner une de ces zones de croissance. La classification de Salter Harris (figure 1) s’intéresse aux fractures passant par le cartilage de croissance.
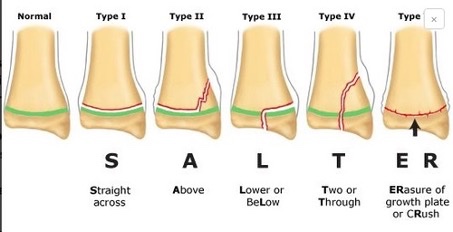
figure 1
Elle est divisée en 5 à 6 stades et présente un intérêt pronostic sur le risque d’épiphysiodèse post-traumatique :
- Type I – Décollement épiphysaire. Le trait de fracture passe uniquement par la zone du cartilage de croissance (sans léser la zone germinale). Le risque d’épiphysiodèse est donc faible dans ce cas.
- Type II – Décollement épiphysaire avec coin métaphysaire. Le trait de fracture passe par la zone hypertrophique du cartilage de croissance et se termine dans la métaphyse sus-jacente. La zone germinale du cartilage de croissance n’est pas touchée, le risque d’épiphysiodèse est faible.
- Type III – Fracture épiphysaire. Le trait de fracture passe par la zone hypertrophique du cartilage de croissance puis traverse le cartilage de croissance et se termine dans l’épiphyse sous-jacente. La zone germinale du cartilage de croissance est traversée par le trait de fracture, le risque d’épiphysiodèse est intermédiaire.
- Type IV – Fracture trans-métaphyso-épiphysaire. Le trait de fracture passe par la métaphyse, le cartilage de croissance et l’épiphyse. La zone germinale du cartilage de croissance est traversée par le trait de fracture, le risque d’épiphysiodèse est élevé.
- Type V – Ecrasement du cartilage de croissance. Il s’agit de traumatismes en compression dont le principal risque est la stérilisation complète du cartilage de croissance par destruction de la zone germinale. Ces fractures sont difficilement visibles sur la radiographie initiale, le diagnostic est le plus souvent rétrospectif et doit être suspecté sur une épiphysiodèse avec antécédent de traumatisme.
- Type VI – Ogden. Il s’agit d’une lésion traumatique de la virole péri-chondrale qui assure la vascularisation du cartilage de croissance. Ce phénomène comporte un risque d’épiphysiodèse périphérique très élevé.
L’identification de ces fractures permet de prévoir un traitement chirurgical adapté visant à réduire le déplacement et à assurer une stabilisation suffisante pour espérer un rétablissement de la vascularisation et une reprise de la croissance osseuse pour la durée de croissance résiduelle. Un suivi radiographique est préconisé dans les mois suivant la fracture afin de dépister le plus précocement possible une anomalie de croissance et une éventuelle déformation du segment osseux afin d’y apporter les correctifs chirurgicaux les plus adaptés.
2. Vascularisation
La vascularisation des futs osseux est particulière chez le jeune et se modifie après la fermeture de la physe. En effet, la zone de croissance constitue une barrière à la vascularisation, rendant obligatoire un apport sanguin spécifique pour l’épiphyse par les vaisseaux épiphysaires provenant de la capsule articulaire (figure 2), le fût osseux étant approvisionné par la vascularisation entrant par les foramens vasculaires diaphysaires. La région métaphysaire, zone d’activité métabolique intense, est particulièrement vascularisée, en faisant le site préférentiel de développement des ostéomyélites hématogènes chez le jeune en croissance. La vascularisation périostée est très développée chez le jeune et permet une croissance en épaisseur du cortex très active. Chez l’adulte, la vascularisation périostée est résiduelle et remplacée par la vascularisation médullaire provenant des foramens nourriciers fusionnée à la vascularisation métaphysaire.
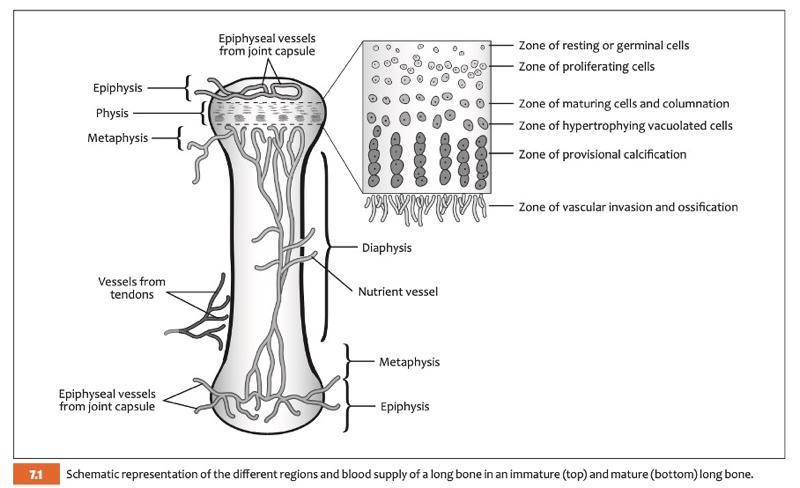
figure 2
Cette vascularisation particulière du jeune peut conduire, suite à un traumatisme notamment, à une anomalie de perfusion de la zone épiphysaire et à une anomalie de croissance voire à une nécrose épiphysaire. On peut envisager un tel mécanisme lors de l’ostéonécrose aseptique de la tête fémorale, des ostéopathies métaphysaires ou des dysplasies de la physe, des glissements épiphysaires.
III- Particularités des fractures du jeune [3]
Outre la zone de croissance et son implication possible dans le site de fracture, l’os du jeune présente un métabolisme très actif qui conduit à un processus de cicatrisation particulier :
- La cicatrisation est plus rapide que chez l’adulte
- La vascularisation périostée abondante, et la solidité du périoste chez le jeune permettent la formation d’un cal périosté très rapide mais parfois exubérant.
- Le traitement des fractures du jeune doit donc être entrepris le plus tôt possible.
- Les remodelages importants autorisent une réduction moins parfaite que chez l’adulte, avec une angulation ou un décalage, car les déformations seront corrigées plus facilement. En revanche, une rotation ne pourra pas être corrigée spontanément.
Chez un jeune animal on peut s’attendre à une durée de cicatrisation de 2 à 8 semaines.
Ces durées sont indicatives et dépendent de nombreux facteurs, notamment du type de fracture, du site fracturaire, du type de réduction, d’éventuels troubles métaboliques, d’une éventuelle surinfection …
Une cicatrisation normale va donner lieu à la formation d’un cal périosté de contour relativement lisse et régulier, peu exubérant, se remodelant rapidement. Toute instabilité ou retard de cicatrisation s’accompagnera de la production d’un os peu structuré, mal délimité, hétérogène. La distinction avec un processus infectieux peut alors devenir difficile. La présence d’un élément osseux non remodelé (contours aigus) au sein d’un tel cal anarchique peut évoquer la présence d’un séquestre osseux (fragment dévascularisé) et conduire à une réintervention chirurgicale.
Dans tous les cas, l’évaluation de la cicatrisation osseuse se fait dans la durée, l’évolution dynamique de l’image étant prépondérante dans l’appréciation du caractère favorable ou défavorable de la progression. La comparaison des nouveaux clichés obtenus avec les clichés précédents est donc indispensable pour aboutir à un diagnostic fiable.
Certaines fractures du jeune peuvent présenter un aspect particulier et une cicatrisation particulière : il s’agit notamment des fractures dites en « bois vert » qui accompagnent l’ostéofibrose d’origine nutritionnelle (hyperparathyroïdisme secondaire). Dans ce cas, l’os se plie plutôt que de se rompre franchement, en raison d’une composition minérale inadaptée. Dans ce cas, on observe une opacité du squelette diminuée, des corticales fines et parfois dédoublée, des déformations osseuses souvent nombreuses et non limitées au site de fracture observé initialement. Le traitement de la fracture devra alors s’accompagner d’une prise en charge nutritionnelle.
IV- Infection osseuse
Les infections osseuses peuvent présenter le même aspect chez le jeune que chez l’adulte, mais, comme déjà évoqué, bien que rares, les ostéomyélites hématogènes sont plus fréquentes à ces âges. On estime qu’elles représentent 3 à 10% de toutes les ostéomyélites et concernent principalement les régions métaphysaires, en raison de la présence de capillaires sinusoïdes dans cette région et/ou d’un endothélium vasculaire discontinu pouvant favoriser l’implantation des germes. L’absence chez les carnivores de vaisseaux transphysaires limite le site d’infection à la région métaphysaire. L’infection peut dans un second temps s’étendre au périoste et aux tissus mous adjacents. Les signes cliniques habituels sont la léthargie, une hyperthermie, une tuméfaction de la zone atteinte, et une boiterie et une douleur intenses.
Sur les radiographies, on observe des foyers métaphysaires radiotransparents, susceptibles de s’étendre à la région diaphysaire en une lyse perméative, une irrégularité sous-périostée et une prolifération osseuse périostée. Une sclérose médullaire et une tuméfaction des tissus mous est possible. En revanche, une atteinte de la physe et une anomalie de croissance sont peu probables. Une telle infection peut être confondue avec un stade précoce d’ostéodystrophie hypertrophique. Elle n’en présente cependant pas le caractère symétrique habituellement observé dans cette affection.
Les infections osseuses non-hématogènes proviennent habituellement d’une inoculation (trauma, morsure …) ou d’une intervention chirurgicale. Elles ne présentent pas de caractère particulier par rapport à l’adulte, en dehors des particularités de la cicatrisation osseuse déjà évoquées. De même pour les infections articulaires, très rares chez le jeune à l’exception d’une inoculation traumatique d’un germe. Distinguer une infection articulaire d’une maladie de croissance comme une nécrose aseptique de la tête fémorale, un glissement épiphysaire.
Des affections plus couramment rencontrées comme la panostéite ou l’ostéodystrophie hypertrophiante devront aussi être distinguées d’un processus infectieux.
Bibliographie
- Small animal pediatrics. 2011. Section III, chapter 21, Matoon, J.S., 169-191.
- BSAVA Manual of canine and feline musculoskeletal imaging. 2016, Kirberger R.M., McEvoy F. J. Chapitres 1, 7, 8 et 10.
- Small animal pediatrics. 2011 Section IV, chapter 42, Breur, G.J., McDonough S.P., TodhunterR.J. 443-460.
> Radiographie osseuse du jeune chien : anomalie constitutionnelle du tissu osseux
Bordeaux France
I- Introduction
Les indications les plus courantes d’examens d’imagerie ostéo-articulaire chez un jeune chien sont une boiterie, une douleur à la palpation ou à la manipulation, un gonflement tissulaire ou articulaire, une ou plusieurs déformations osseuses ou d’un membre entier, une angulation anormale, une amyotrophie, une mobilité anormale ou un traumatisme. Mais certaines maladies métaboliques ou systémiques peuvent également avoir des répercussions ostéo-articulaires à rechercher.
Les maladies ostéo-articulaires du jeune incluent des maladies de développement (dysplasies articulaires, nécrose aseptique de la tête fémorale chez le chien, glissement de la tête fémorale chez le chat), congénitales (malformations, luxation de patelle, ossification incomplète du condyle huméral, asynchronisme de croissance radio-ulnaire, dysplasies osseuses, dysostoses comme la polydactylie, osteogenesis imperfecta, ostéopétrose), métaboliques (primaires ou secondaires), infectieuses, tumorales ou traumatiques.
II- Technique sémiologique
Il est important d’obtenir des radiographies de très bonne qualité, car les lésions sont parfois subtiles. Une sédation peut tout d’abord être nécessaire chez un jeune animal difficile à contenir :
- butorphanol 0,2 mg/kg IV/IM ou métadone 0,2 mg/kg IV/IM selon l’intensité de la douleur
- midazolam 0,2 mg/kg IV/IM (pratique en IM chez le chat) ou diazepam 0,2 mg/kg IV
Des projections orthogonales voire un examen tomodensitométrique sont indispensables afin de localiser les lésions et de bien interpréter leur signification.
Chez un chien en croissance, il est important de bien connaitre l’anatomie des cartilages de croissance et leur rythme d’ossification et de fermeture. Les astuces sont de comparer avec le membre controlatéral ou avec un animal de la même portée ou du même gabarit au même âge.
La sémiologie ostéo-articulaire inclut :
- l’analyse des tissus mous (localisation, gonflement, changement d’opacité),
- l’analyse des articulations (mono- ou polyarticulaire, uni- ou bilatéral, changement d’opacité, défaut d’alignement, l’os sous-chondral
- l’analyse des os (mono- ou polyostotique, changement d’opacité, localisation (épiphyse, métaphyse, diaphyse, squelette axial, ostéoprolifération, ostéolyse, zone de transition)
III- Les affections
Les maladies métaboliques sont soit primaires et génétiques soit secondaires, d’origine rénale ou nutritionnelle par exemple. Elles affectent le plus souvent le squelette dans son ensemble. Il s’agit d’un déséquilibre entre production et résorption osseuse. Les lésions sont le plus souvent bilatérales et symétriques, plus sévères chez des animaux en croissance. Les critères principaux à analyser sont : l’opacité générale de l’os, l’épaisseur des corticales des os longs, les fractures pathologiques, l’épaisseur des cartilages de croissance, la forme et l’opacité des métaphyses.
Les critères de distinction de ces maladies sont regroupés dans le tableau de la figure 1 : critères diagnostiques en radiologie des maladies osseuses métaboliques du jeune.
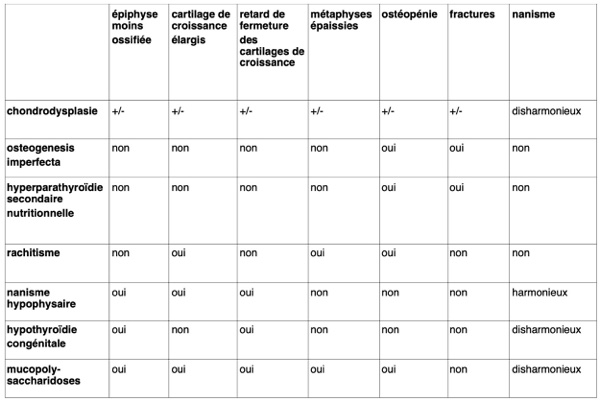
Figure 1 : critères diagnostiques en radiologie des maladies osseuses métaboliques du jeune.
Il existe un certain nombre de maladies ostéoarticulaires du jeune non-classifiées. Un jeune chien avec fièvre et douleur osseuse doit évoquer une panostéite ou une ostéopathie métaphysaire (= ostéodystrophie hypertrophique). L’ostéopathie cranio-mandibulaire est une maladie héréditaire qui touchent particulièrement les chiens de type Terrier, entre 3 et 8 mois, de cause inconnue. On observe une ostéoprolifération en chou fleur qui se lisse en fin de croissance. Elle touche le crâne, les mandibules, les articulations temporo-mandibulaires, de manière symétrique ou unilatérale. Elle est parfois associée à une ostéopathie métaphysaire sur les os longs.
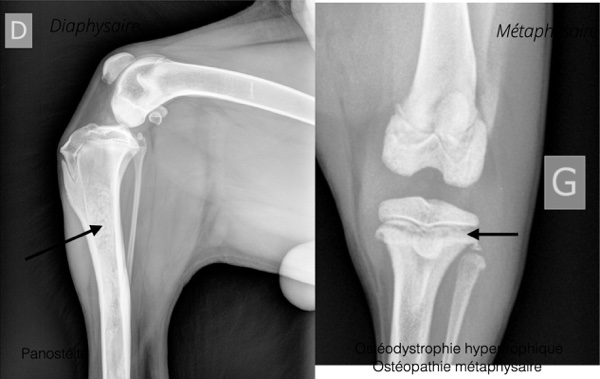
Figure 2 : comparaison radiographique de la panostéite et de l'ostéopathie métaphysaire
Bibliographie
- R. Dennis et al. Handbook of Small Animal Radiology and Ultrasound 2nd ed. Churchill Livingstone Elsevier, St Louis, USA. 2010.
- F. Barr. Chapter 3 Long bones - juvenile. BSAVA Manual of Canine and Feline Musculoskeletal Imaging. Blackwell Publishing, Ames, Iowa, USA. 2006.
> Anomalie de croissance : dysplasie articulaire ou dysplasie osseuse
Lyon France
I- Introduction
Une dysplasie se définit comme une anomalie dans le développement d’un tissu ou d’un organe, se traduisant par des malformations. Les causes sont variables, parfois héréditaires (mucopolysaccharidose, …), ou acquises (troubles nutritionnels, …), et parfois multifactorielles (développementales, race,...). Les dysplasies articulaires sont beaucoup plus connues que les dysplasies osseuses, car beaucoup plus fréquentes. Plus confidentielles, les dysplasies osseuses sont quant à elles à l’origine de conséquences souvent dramatiques sur la fonction de l’os et l’aspect du squelette.
II- Les dysplasies articulaires
1. La dysplasie du coude
a) Qu’est-ce que c’est ?
La dysplasie du coude inclut quatre types de lésions développementales indépendantes ou concomitantes : la non-union du processus anconé (NUPA), la fragmentation du processus coronoïde médial de l’ulna (FPCM), l’ostéochondrose de la partie médiale du condyle huméral et l’incongruence articulaire.
b) Quel examen choisir ?
- Place de la radiographie
La radiographie n’est pas l’examen le plus sensible pour explorer une dysplasie du coude. En effet le seul signe radiographique de dysplasie du coude souvent visible est l’arthrose quelle induit. Les signes précoces d’arthrose sont la présence de productions osseuses sur le processus anconé, les épicondyles huméraux et une sclérose en regard de l’incisure ulnaire.
La radiographie demeure cependant l’examen le plus disponible en pratique courante et permet parfois un diagnostic aisé comme lors de NUPA. La radiographie manque en revanche de sensibilité pour les lésions du PCM et du condyle huméral.
- Le scanner
Chez le jeune animal suspect de dysplasie du coude, l’obtention d’un diagnostic précoce, si possible avant l’apparition de remaniements osseux arthrosiques, est l’une des clés de la réussite thérapeutique. Le scanner peut donc être considéré comme l’examen de choix en première intention lors de boiterie du coude chez le jeune.
Le scanner est plus sensible que la radiographie et permet un diagnostic précoce (dès 6 à 7 mois) des lésions du PCM. Les lésions coronoïdiennes observées sont variables : hétérogénéité (chondromalacie) ou sclérose de l’os sous-chondral, forme anormale (émoussée), plage hypodense, fissuration complète ou incomplète, fragmentation.
Les signes de remaniements secondaires du coude (ostéophytes, sclérose de l’incisure trochléaire, remaniements de la trochlée humérale type « kissing lesion ») sont également facilement détectés au scanner.
Le scanner est la technique d’imagerie de référence pour le diagnostic de l’incongruence articulaire. Il permet l’évaluation de la congruence dans différents plans. Les lésions sont les mêmes qu’à la radiographie : décalage entre les articulations huméro-ulnaire et huméro-radiale (« marche d’escalier »), déformation de l’incisure ulnaire, élargissement de l’articulation huméro-radiale, déplacement crânial du condyle huméral.
Le scanner présente cependant lui aussi ses limites puisqu’il ne permet pas d’évaluer le cartilage, contrairement à l’arthroscopie. Ainsi une lésion purement cartilagineuse et/ou non déplacée peut ne pas être visualisée au scanner. L’absence d’anomalie au scanner ne permet donc pas d’exclure une dysplasie du coude. A l’inverse, certaines lésions visibles au scanner (fragmentation axiale du PCM, fissure profonde) ne sont pas directement visualisées en arthroscopie et nécessitent une palpation profonde pour être mise en évidence. L’arthroscopie (diagnostique) et le scanner sont donc deux techniques complémentaires.
2. La dysplasie des hanches
La dysplasie coxo-fémorale est une affection courante en médecine vétérinaire, avec de sérieuses conséquences potentielles sur la mobilité et la qualité de vie de l’animal. La radiographie reste aujourd’hui encore l’examen de choix pour son diasgnostic.
a) Examen d’une vue ventro-dorsale en extension
Il s’agit de la vue de référence utilisée par la plupart des organismes de certification. Une radiographie de bonne qualité technique est indispensable à une bonne interprétation.
- Rechercher des signes d’arthrose
Lors d’arthrose avancée, l’articulation est très remaniée et le diagnostic généralement univoque. La tête fémorale présente une forme anormale, la cavité acétabulaire est peu profonde, comblée par des productions osseuses, de même que le col fémoral. Une sclérose importante de l’acétabulum et de la tête fémorale est notée.
Il est bien plus difficile, et intéressant, de diagnostiquer les signes d’arthrose les plus précoces. Il s’agit là de mettre en évidence la présence de productions osseuses péri-articulaires appelées ostéophytes. Ces derniers vont se localiser en regard de la tête fémorale, du col fémoral et des marges de l’acétabulum.
Deux sites privilégiés sont classiquement observés (Figure 1) :
-
- le long du col fémoral, on parle alors de ligne d’ostéophytose curviligne caudale (OCC), ou encore de ligne de Morgan;
- le long de la tête fémorale, on parle alors de ligne d’ostéophytose circonférentielle de la tête fémorale (OCTF).
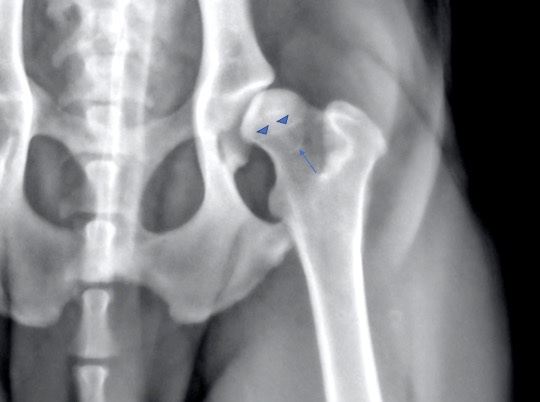
Figure 1
Ces deux lignes d’ostéophytose sont significativement associées au développement d’arthrose plus sévère avec le temps.
- Rechercher une hyper-laxité articulaire
Bien que certains signes d’arthrose apparaissent très rapidement avec l’évolution de la maladie, une hyperlaxité la précède toujours et est donc le critère le plus précoce que l’on puisse mettre en évidence.
Ainsi, même en l’absence de signe d’arthrose à la radiographie, la présence d’une subluxation coxo-fémorale sur une vue en extension est considérée comme diagnostique de dysplasie.
L’évaluation du degré de congruence/subluxation de l’articulation se fait de manière subjective mais également à l’aide de deux mesures :
-
- le degré de recouvrement de la tête fémorale par le bord dorsal de l’acétabulum devant être supérieur à 50%;
- l’angle de Norberg Olsson devant être supérieur à 105°.
b) Les vues en contrainte (distraction) : un point sur la technique
La méthode PennHip repose sur l’acquisition de 3 vues radiographiques ventro-dorsales différentes, sous anesthésie générale :
- une vue classique en extension;
- une vue en compression permettant d’évaluer la congruence articulaire;
- une vue en distraction permettant de calculer l’indice de distraction;
- l’indice de distraction.
L’indice de distraction (ID) est calculé pour chaque hanche sur la vue radiographique en distraction (Figure 2) en réalisant un rapport entre deux longueurs (ID = d/r) :
- la distance entre le centre de l’acétabulum le centre de la tête fémorale (d);
- le rayon de la tête fémorale (r).
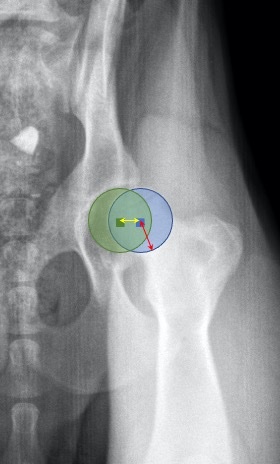
Figure 2
L’indice de distraction est calculé grâce au ratio entre la distance (double flèche jaune) entre le centre de la tête fémorale (cercle bleu) et le centre de la cavité acétabulaire (cercle vert), et le rayon de la tête fémorale (double flèche rouge).
Un indice de distraction de 0 signifie une congruence parfaite sans aucune laxité. Un indice de 1 est quant à lui synonyme de luxation complète. Cet indice permet une comparaison objective des animaux entre eux et introduit une notion de proportionnalité. Une hanche dont l’ID est de 0,4 présente ainsi deux fois moins de laxité qu’une hanche dont l’ID est de 0,8. Par ailleurs, un indice de 0,4 signifie que le degré de subluxation de l’articulation est d’environ 40%.
Un ID de moins de 0,3 est associé à un risque de développer une arthrose coxo-fémorale quasi nul, tandis qu’un indice supérieur à 0,8 est associé au développement d’arthrose de manière quasi-certaine.
La valeur seuil utilisée pour déterminer qu’un animal n’est pas à risque de développer de l’arthrose est dépendant de chaque race. La valeur de 0,3 est communément admise de manière générale.
III- Les dysplasies osseuses
Les dysplasies osseuses sont très variées et leur classification reste encore imparfaite. On distingue les dysplasies d’origine génétique de celles d’origine métabolique.
1. Les dysplasies congénitales
a) Les chondrodysplasies
Il s’agit d’un large groupe d’anomalie de développement du cartilage, impliquant l’épiphyse, la physe ou la métaphyse des os long, les plateaux vertébraux ou n’importe quelle combinaison.
Les signes radiographiques associés sont :
- une croissance ralentie avec des os plus courts et plus épais;
- un élargissement des physes;
- une potentielle rétention du cartilage de croissance au sein de la métaphyse;
- une apparition tardive des centres d’ossification séparés;
- des épiphyses de formes anormales ou dites « en pointillés »;
- un défaut d’ossification ou une forme anormale des plateaux vertébraux.
La combinaison spécifique de ces différents éléments avec les critères épidémiologiques permet de déterminer plus précisément le type de chondrodysplasie.
On citera notamment :
- la mucopolysaccharidose;
- l’ostéochondrodystrophie du chat Scottish Fold;
- la chondrodysplasie du Malamute de l'Alaska;
- la chondrodysplasie oculaire du Retriever du Labrador;
- la dysplasie épiphysaire multiple du Beagle.
b) Osteogenesis imperfecta
Il s’agit d’un défaut en collagène de type I à l’origine d’une fragilité osseuse.
On observe radiographiquement une diminution globale de l’opacité osseuse et des fractures pathologiques à différents stades de cicatrisation à l’origine de déformation angulaire par malunion.
c) Les dysostoses
Les dysostoses représentent des anomalies sporadiques du développement du squelette, localisé à un os unique ou une partie d’un os.
Il peut s’agir d’une agénésie totale (amélia) ou partielle (hémimélia) d’une partie d’un membre, la plupart du temps secondaire à des facteurs environnementaux in-utero.
L’ectrodactylie est une forme assez caractéristique de dysostose caractérisée par une séparation de la partie distale d’un membre thoracique. Elle est parfois appelée déformation en pince de crabe.
2. Les dysplasies métaboliques
Elles sont importantes à reconnaître car potentiellement corrigeables si leur cause est traitable. Ces dysplasies osseuses sont généralement plus conséquentes chez les jeunes animaux en raison de leur activité osseuse importante. La physe distale du radius, de l’ulna et du tibia sont particulièrement concernées car très actives.
Les points essentiels permettant de suspecter une dysplasie d’origine métabolique à la radiographie sont les suivants :
- une diminution globale de l’opacité du squelette;
- un amincissement des corticales des os longs;
- la présence de fractures multiples, à différents stades de cicatrisation;
- un élargissement des physes;
- une modification des métaphyses (évasement, opacité).
Les causes les plus fréquentes sont :
- l'hyperparathyroïdie d’origine nutritionnelle ou rénale (dysplasie rénale notamment);
- Llhypovitaminose D;
- l’hypothyroïdie congénitale;
- le nanisme hypophysaire;
- l’hypervitaminose A.
Chacune présente des spécificités radiographiques et anamnestico-cliniques permettant de les suspecter plus précisément. L’hyperparathyroïdisme nutritionnelle est par exemple rencontré chez les animaux nourris exclusivement à base de viande crue, et l’hypervitaminose A souvent chez des chatons nourris avec du foie. L’hypovitaminose D se caractérise quant à elle par un élargissement très marqué des physes, pouvant avoir un aspect biconvexe.
> Metabolisme osseux, radioanatomie normale en croissance
Saint-Laurent-Du-Var France
I- Introduction
L’examen radiographique est la principale modalité d’évaluation du squelette. L’apparence radiographique dépend de phénomènes physiologiques comme pathologiques. Il est important d’en comprendre les tenants et aboutissants, intérêts et limites. Nous rappellerons dans un premier temps les principes généraux du métabolisme et de la physiologie de l’os chez l’animal en croissance avant d’aborder l’aspect radiographique normal chez le jeune carnivore domestique.
II- Physiologie de l’os en croissance.
On réduit souvent la croissance osseuse aux plaques de croissances métaphysaires. En réalité le développement du squelette chez le jeune implique de multiples mécanismes. On distingue généralement les os plats (crâne, scapulas, bassin), os courts (vertèbres, os cuboïdes) et os longs. Ces différences sont avant tout morphologiques et il existe de nombreux éléments communs.
1. Structure osseuse de base
Le squelette sert de soutien aux différentes parties du corps tout en assurant leur mobilité. Il a aussi un rôle de protection de certains organes. Enfin, il joue un rôle métabolique complexe, non seulement comme réservoir de minéraux mais aussi comme élément actif de l’homéostasie, hématopoïèse, métabolismes des lipides, du glucose etc.
Les os des tétrapodes consistent en une trame tridimensionnelle d’os spongieux ou trabéculaire, entourée par une capsule d’os dense, l’os cortical ou compact, et des enveloppes de tissus conjonctif, le périoste à l’extérieur, l’endoste tapissant la face interne des corticales et des lames d’os spongieux. ce dernier et la cavité diaphysaire contiennent la moelle osseuse, riche en tissus adipeux, conjonctif, vasculaire et en cellules hématopoïétiques. S’y ajoutent les cartilages de croissance et articulaires, les capsules, tendons, aponévroses, ligaments etc. L’os fait partie intégrante d’un continuum allant d’une extrémité du corps à l’autre.
2. Ostéogénèse
L’os, particulièrement durant la croissance, possède un potentiel de régénération et une plasticité incroyables. C’est un tissu mésenchymateux, contenant ostéoblastes, ostéocytes, ostéoclastes, une matrice minéralisée et des tissus conjonctifs, adipeux, vasculaires, nerveux et fibreux. La matrice est une trame protéïque très organisée, riche en collagène de type I. De nombreux types de cellules souches résident dans les tissus minéralisés et dans la moelle osseuse, produisant les cellules osseuses du jeune mais conservant un potentiel progéniteur chez l’adulte. Deux modes d’ostéogénèse prédominent.
a) Ossification endochondrale (Figure 1)
En fin de développement foetal, les os courts et longs sont formés d’une ébauche de cartilage hyalin. La pénétration orchestrée de vaisseaux sanguins entraine la formation de noyaux d’ossification, au centre des diaphyses et des épiphyses. Le cartilage initial croît à partir des cellules de la périphérie (périchondre) de manière centripète : les chondroblastes se divisent pour former des colonnes vers le centre de l’os. La matrice se minéralise puis est envahie par des bourgeons vasculaires accompagnés de tissus conjonctifs, cellules souches, nerfs etc. De l’os lamellaire encore peu organisé remplace le cartilage minéralisé pour former une matrice d’os primaire.
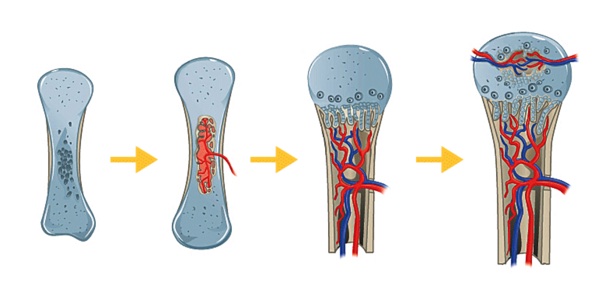
Figure 1: représentation schématique des différents stades de développement d’un os long par ossification endochondrale (de gauche à droite) - Depuis la maquette cartilagineuse au noyau d’ossification s’étendant dans la diaphyse, la formation de la plaque de croissance métaphysaire et enfin l’apparition des noyaux épiphysaires.
Lorsque les noyaux d’ossification ont atteint les limites de la diaphyse ou des épiphyses, une zone de transition cartilagineuse persiste, les cartilages de croissance : plaque de croissance métaphysaire (« physe ou cartilage de conjugaison ») entre épiphyse et diaphyse, assurant la croissance en longueur de la diaphyse ; cartilage de croissance articulaire entre le cartilage articulaire et les noyaux épiphysaires qui assure la croissance en longueur et épaisseur des épiphyses.
La croissance en épaisseur des os se fait par ossification endomembraneuse à partir du périoste.
b) Ossification endomembraneuse
Les cellules de la couche interne du périoste assurent l’apposition d’os autour des os. Des cellules ostéogéniques se multiplient autour de néoformations vasculaires, se différenciant en ostéoblastes. Dans tous les cas, la substance osseuse (ostéoïde) initiale forme le tissu osseux primaire, d'architecture peu organisée et peu résistante. Il est rapidement remplacé par de l’os secondaire par invasion de nouveaux bourgeons vasculaires, formant des cylindres d’os lamellaire autour du tissu conjonctivo-vasculaire, les ostéons, conférant à l’os ses propriétés physiques. En même temps, les logettes des os spongieux et la cavité médullaire des diaphyses s’étendent par l’action d'ostéoclastes de l’endoste. L’os prend peu à peu sa forme et sa taille finales. Ces mécanismes permettent la formation puis croissance des os, mais aussi leur entretien et la réparation de lésions.
3. Métabolisme de l’os en croissance
La croissance dépend avant tout de caractères génétiques, mais aussi de nombreux autres facteurs, qui affectent la durée et l’amplitude du développement osseux et peuvent entrainer des anomalies de croissance :
- locaux, notamment mécaniques, biochimiques (composition et organisation de la matrice protéique, taux d’oxygène), humoraux (BMPs, facteurs de croissance, interactions cellulaires etc.) ; vasculaires, notamment invasion des cartilages et os primaire par les bourgeons capillaires et apports nutritionnels (les anomalies cardiovasculaires entrainent des déficits de croissance).
- environnementaux, notamment physiques (poids, activité physique) et nutritionnels (apports et équilibre en vitamines, minéraux, oligo-éléments, énergie etc.)
- systémiques, principalement l’effet des hormones contrôlant l’activité des ostéoblastes et ostéoclastes. Les hormones parathyroïdiennes (PTH et ostéocalcine) contrôlent la calcémie par l’équilibre entre dépôt et résorption osseuse en fonction de facteurs nutritionnels, rénaux et systémiques. La vitamine D, les hormones sexuelles et stéroïdiennes sont intimement impliquées dans ces processus.
- La trame protéïque de l’os est fondamentale. Elle forme l’architecture du squelette et le support des minéraux. Elle est formée en grande partie de collagène de type I. Sa synthèse par les ostéoblastes, fibroblastes et autres progéniteurs dépend des facteurs décrits plus haut, mais aussi du contrôle par l’hormone de croissance, les hormones thyroïdiennes et sexuelles etc. La vitamine A aurait aussi un important rôle régulateur.
III- Radio-anatomie du squelette en croissance
Une radiographie est le reflet de la proportion de rayons X transmis ou absorbés par les tissus. L'image créée dépend de la proportion de minéraux, de la densité des tissus, donc de leur structure, et de leur épaisseur, déterminant la capacité d’absorption des rayons X. La radiographie n’est pas très sensible pour évaluer la densité osseuse : il faut une variation de 30-50% du contenu minéral avant qu’une différence d’opacité soit visible. La minéralisation étant progressive chez le jeune, son degré réel est systématiquement sous-évalué et les constantes radiologiques doivent être relativement diminuée chez un très jeune animal.
Les premières semaines après la naissance, seuls certains noyaux d’ossification secondaire sont minéralisés (humérus, radius, crête iliaque, calcanéus et talus). L’essentiel des os est initialement composé de cartilage hyalin et donc se confond avec les autres tissus mous (les contours osseux sont indiscernables des muscles et autres tissus mous).
Avec l’âge, comme nous l’avons abordé plus haut, ces noyaux apparaissent graduellement, puis s’étendent de manière centrifuge. Les os se remanient graduellement jusqu’à former des contours nets. Les plaques de croissance restent d’opacité liquidienne et la présence des cartilages de croissance articulaires, indiscernables des cartilages hyalins ou du liquide synovial, donnent l’impression que les espaces articulaires sont beaucoup plus épais que chez l’adulte. Chez le très jeune animal, les noyaux d’ossification peuvent avoir des contours un peu irréguliers.
L’anatomie du squelette varie énormément en fonction de l’âge chez l’animal en croissance et il est important de connaitre ces stades de développement en fonction de l’âge. Il existe cependant une énorme variabilité entre espèces, races, sexes, individus dans les stades de développement.
Plusieurs études ont tenté de déterminer l’âge auquel les noyaux d’ossification deviennent visibles radiographiquement, puis celui auquel les plaques de croissance disparaissent. Le tableau I montre les dates approximatives d’apparition des noyaux d’ossification des principaux os chez le chien et le chat. Ces chiffres correspondent chez le chien à des animaux de taille moyenne (20-25kg) selon les publications disponibles.
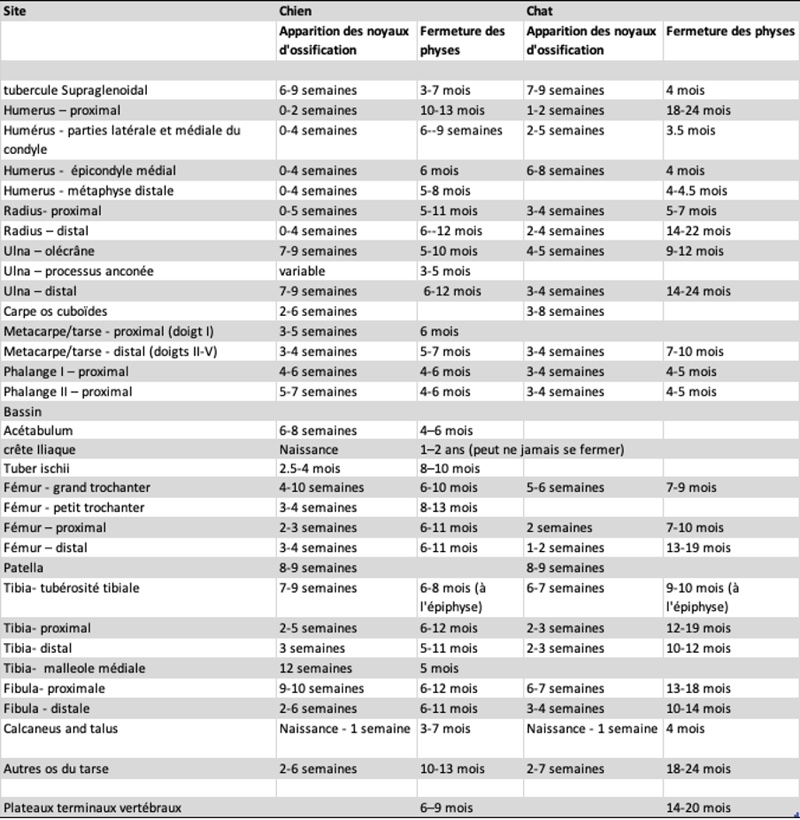
Tableau I : Dates d’apparition des noyaux d’ossification et de fermeture des plaques de croissance (physes) du chien et du chat. (d'après Sumner-Smith, 1966; Smith, 1968, 1969; Morgan, 1981; Dennis et al., 2001).
La croissance du chien se déroule principalement avant l’âge de 6 mois, elle est maximale de 3 à 6 mois puis la croissance se ralentit alors que le squelette et les tissus mous continuent de se développer en masse et se remanier. Un chien de taille moyenne atteint 90% de sa taille adulte vers 9 mois et la croissance est généralement terminée vers 12 mois. Les plaques de croissance métaphysaires des os longs se ferment normalement entre 4 et 12 mois. Les grandes races de chien ont une croissance plus longue, leurs noyaux d’ossification apparaissent plus tard et leurs plaques de croissance se ferment donc plus tardivement que dans les petites races. On sait d’autre part que la stérilisation chez le mâle comme la femelle retarde la date de fermeture des physes.
La fermeture des plaques de croissances apparaît plus tardive chez le chat que chez le chien. Elle commence vers 3 à 4 mois, se termine généralement vers 9 mois mais certaines plaques de croissance, notamment le tibia distal, se ferment jusqu’à 22 mois. Chez le chat mâle, la castration retarde très significativement la fermeture des cartilages de croissance.
Pour les vertèbres, des noyaux d’ossification sont présents au centre des corps vertébraux et à la base des pédicules à la naissance. Les noyaux épiphysaires apparaissent vers un mois alors que les noyaux des arcs vertébraux se rejoignent dorsalement. L’atlas présente plusieurs centres d’ossification : les noyaux de la base et de l’extrémité (proatlas) de la dent apparaissent peu après la naissance et fusionnent avant 6 mois. Le corps et la base de la dent fusionnent vers 3 mois. Les plaques de croissance épiphysaires crâniales ferment vers 9 mois, les caudales avant 12 mois. La fusion des 3 vertèbres sacrées est la dernière à se produire, vers 12 mois. La fermeture des physes vertébrales est un peu plus précoce chez le chat.
Enfin la crête iliaque apparaît vers 4 mois et est le dernier élément du squelette à fusionner, vers l’âge de 2,5 ans.
