> Adoption d'un lapin
Hautot Sur Mer
I- Déroulement de la visite d’adoption chez le lapin
1. Anamnèse et commémoratif
Lors de la visite d’adoption, une anamnèse complète est essentielle : origine de l’animal (élevage, animalerie, particulier, association), installation en extérieur ou intérieur, alimentation et comportement) (Varga 2014, Crowell-Davis 2021).
2. Examen clinique
L’examen clinique rapproché doit être complet : de la tête au pompon en prenant soin à la contention du bassin. Il est utile de mettre en place une approche systématique. Le déroulement présenté ici est un exemple.
Les constantes vitales sont donc à prendre en premier (fréquence respiratoire, fréquence cardiaque, température corporelle) (Quesenberry 2012, Richardson 2013). L’auscultation se termine par celle des bruits digestifs. La température peut être prise après l’étape de l’auscultation afin d’éviter une augmentation de cette valeur par le stress (Quesenberry 2012, Richardson 2013). Le sexage doit systématiquement est réalisé car de nombreuses erreurs sont observées en pratique (Quesenberry 2012, Richardson 2013). Ensuite le patient est re-installé sur sa serviette pour un examen de la tête, du corps, du ventre et des dents (Richardson 2013).
3. Dépistage et prévention des troubles congénitaux ou liés à la croissance
- Le terme de « brachycéphale » désigne les individus aux conformations de tête particulièrement écrasée, avec un museau raccourci et un crâne court (Harvey 2019). Chez ces lapins les sinus sont courts, ce qui engendre une inspiration forcée. Une thèse vétérinaire a d’ailleurs pu montrer que les lapins nains de moins de 1kg présentent plus de maladies et de symptômes respiratoires (éternuements, écoulements des yeux, narines, bruits respiratoires augmentés, ronflement, toux…) que les lapins d’un poids supérieur (Gay 2022).
- De plus, il a été mis en avant que la conformation du crâne influe sur le développement de malocclusion dentaire (Gay 2022). Ce problème est rencontré généralement chez les races naines vers l’âge de 3 à 16 semaines et est fortement influencé par des composantes génétiques tel qu’un défaut de l’émail (Gay 2022). Un travail de 2017 conclut que ces lapins ont trois fois plus de risques de développer une pathologie dentaire que les lapins de race non brachycéphale (Böhmer 2017, Siriporne 2017).
- Concernant les races géantes (>5kg), il est connu qu’elles sont prédisposées à une arthrose précoce par rapport aux petites races (UC Davis, January 2004-November 2010), en particulier au niveau des grassets et des hanches. Néanmoins, à l’heure actuelle, aucune étude ne montre l’effet d’une stérilisation précoce sur la croissance de ces grandes races. Cependant une stérilisation au-delà des 18 mois reste préconisée.
II- Recommandation
1. Alimentation
Herbivore strict, le lapin est aussi un excellent sélectionneur d’aliment : concentrés et herbes ! (Bradley 2000, Proença 2014, Hatt 2017).
- Le foin :
Sa ration alimentaire se compose en très grande majorité de foin de bonne qualité et/ou d’herbe. Le foin doit être vert, non poussiéreux, non coupé avec de la paille, aéré et d’une bonne odeur.
Le foin permet l’apport de fibres non digestibles assurant la motilité du colon et l’apport de fibres digestibles pour la réalisation de caecotrophie. Un taux de fibres non digestibles trop bas (<12,5%) inhibe le péristaltisme normal du gros intestin. A l’inverse un excès de fibres digestibles augmente la caecotrophie et la production d’acide gras volatiles. Cela engendre des modifications du pH caecal qui entraînent une dysbiose. Le foin permet également l’usure dentaire chez notre patient hypsodonte et élodonte dont la croissance dentaire continue varie de 2 à 2,4 mm/semaine (Bradley 2000, Proença 2014, Hatt 2017). Un foin de dicotylédones à base de luzerne, trèfle et herbe est plus riche en calcium et protéines et donc plus adapté aux jeunes (Bradley 2000, Proença 2014, Hatt 2017).
- La verdure :
Pour un apport en vitamines et minéraux, une verdure fraîche et variée (5 végétaux différents/jour) doit être proposée à raison de 80g/kg/j en deux repas. Le feuillu est à favoriser. Elle permet le transit, l’apport de vitamines et minéraux, une hydratation et agit dans la prévention des lithiases si elle est bien choisie. Les végétaux riches en oxalates (choux, épinards etc.) peuvent être proposés chez les jeunes (Hatt 2017).
- Les extrudés ou granulés :
Le choix de la distribution de granulés ou extrudés doit être mené sur le besoin d’apport en vitamines et minéraux qu’il est impossible d’évaluer précisément avec la portion de végétaux. Proposés de manière rationnée, à raison de 0 à 5% du poids vif de l’animal (30 à 40g/j selon le poids du lapin), il est important de vérifier leur composition en cellulose brute CB (>20%), matière grasse MG (<5%) et taux de protéine (12 à 16%).
Le taux de calcium minimum recommandé pour un lapin en croissance au laboratoire est de 0,22% pour une croissance optimale et 0,44% pour une bonne calcification osseuse et dentaire. Pour les lapins adultes sains, un taux de 0,4-1% semble assurer un équilibre correct (Proença 2014, Hatt 2017). Les granulés extrudés ne peuvent pas être donnés à volonté y compris une gamme junior. La transition vers des extrudés adultes s’effectue entre 4 et 12 mois selon les gammes (Proença 2014, Hatt 2017).
Contrairement à la croyance populaire, les lapins géants n'ont pas besoin de plus de granulés ou d’extrudés ni de complément minéral ou vitaminique dans leur alimentation, s'ils sont nourris comme indiqué ci-dessus (Proença 2014, Hatt 2017). Le régime 100% granulés favorise maladie dentaire et embonpoint.
Les mélanges de graines, pains et céréales sont à proscrire. Riches en amidon, non équilibrés en apport phospho-calcique, ils sont à l’origine d’une prise alimentaire sélective et malnutrition. (Proença 2014, Hatt 2017).
- L’eau :
Le besoin hydrique du lapin (120ml/kg/j) est dix fois supérieur à celui du chien et du chat. Il boit nettement plus en gamelle qu’en biberon (Proença 2014, Hatt 2017).
2. Habitat
Le lapin est un animal social qui vit en groupe et qui, s’il a le choix, choisit activement la compagnie (Huls 1991, Dalle et al, 2009, Edgar, Seaman 2010).
Il est donc préférable d’en avoir au minimum deux. L’entente entre mâle et femelle est l’association la plus facile après stérilisation. Il peut vivre en intérieur ou en extérieur mais sa zone de confort thermique se situe autour de 20°C (<10°C et >30°C). Il est très sensible au coup de chaleur. Il a besoin d’un environnement humide (55-65%). Cette hygrométrie limite les rhinites chez les individus prédisposés (« babyface », minilop).
En extérieur, il doit être en enclos sécuritaire fermé sur le toit et grillagé dans le sol, sur de l’herbe, aménagé de cachette et coin d’ombre pour l’été.
Le lapin en intérieur peut vivre en cage ouverte ou enclos de 3m sur 2,5m pour un couple (Speight, 2016). Cet enclos doit être composé d’un bar à foin avec une litière non poussiéreuse non parfumée, une zone de repos (tapis, cachette) et de jeux (tunnel, bac de grattage, table alimentaire variée etc.) (Normando, Gelli, 2011).
La liberté totale est idéale pour favoriser la mobilité et l’enrichissement du milieu. Néanmoins elle nécessite des aménagements intérieurs : plantes en hauteur, fils électriques dans des gaines etc. Comme on peut s'y attendre, les races géantes ont besoin d'un logement beaucoup plus grand : un grand abri de 4 m de long une volière ou une maison pour lapins ainsi qu’un parcours extérieur peut y être ajouté (Speight, 2016).
3. Programme vaccinal et antiparasitaire
La vaccination est recommandée contre 2 principaux pathogènes viraux préoccupants : le virus de la maladie hémorragique du lapin (RHDV) et la myxomatose. Depuis plusieurs années, le RHDV-2 a remplacé les souches RHDV et RHDVa en circulant dans la plupart des pays européens, en Australie et en Amérique du Nord. Compte tenu de l’absence de protection croisée entre le variant classique (vhd1) et le variant vhd2, il est nécessaire de vacciner les lapins contre ces deux variants.
Concernant le RHDV, une vaccination initiale entre 7 et 12 semaines est possible et est conseillée par la suite tous les 6 à 12 mois selon le risque (Sutherland 2021). Un vaccin actif contre et le virus de la myxomatose et les virus de RHD est réalisable à partir de 5 semaines d’âge et dure un an.
Néanmoins l'interférence vectorielle est un problème avec Nobivac Myxo-RHD PLUS chez les lapins qui ont été précédemment vaccinés avec Nobivac Myxo-RHD sans vaccination supplémentaire contre le RHDV2. C'est également un problème chez les lapins qui ont été exposés à la myxomatose. Ces lapins doivent être vaccinés contre le RHDV2 avec Eravac® ou Filavac® avant de recevoir Nobivac Myxo-RHD PLUS deux semaines plus tard.
Chez les lapins qui n'ont certainement pas été vaccinés contre la myxomatose ou qui n'y ont pas été exposés, par exemple les jeunes lapins, une seule vaccination à l'âge de 10 semaines ou plus avec Nobivac Myxo-RHD PLUS est suffisante, sauf s'il y a un risque d'exposition immédiate au RHDV2.
Si les antécédents de vaccination sont incertains ou si les vaccinations ont été interrompues, l'option la plus sûre consiste à administrer un vaccin RHDV2 inactivé avec adjuvant (Eravac® ou Filavac® suivi de Nobivac Myxo-RHD PLUS deux semaines plus tard si la vaccination contre la myxomatose est également prévue. En 2021, une souche hypervirulente de vhd-2 a entrainé le décès de lapins d’élevage correctement vaccinés. Une vaccination RHDV2 tous les 6 mois reste préconisée.
La lutte contre ces maladies virales passe également par l’utilisation d’antiparasitaire externe car les insectes piqueurs et non piqueurs sont vecteurs de la myxomatose et de la vhD.
III- Conclusion
Une fois le bilan d’adoption réalisé, un plan de prévention et/ou de santé peut être proposé au propriétaire afin d’organiser le suivi de l’animal pour la suite. L’idéal est de proposer des bilans pré-acquisition.
Références
- Pilny AA. Small Exotic Companion Mammal Wellness Management and Environmental. Vet Clin Exot Anim.2015 ; 18 : 245–254.
- Richardson J, Keeble E. In : BSAVA Ed, Manual of Rabbit Medicine. Physical examination and clinical techniques. Gloucester : 2013 : 80-89.
- Gay M. Les hypertypes chez le lapin de compagnie : Etude de la brachycéphalie par une enquête terrain et par des mesures craniométriques. Nantes : Faculté de Médecine de Nantes, 2022.
- Proença LM, Mayer J : Prescription Diets for Rabbits. Vet clin Exot Anim. 2014.
- Volait Rosset L. Rabbit Hemorrhagic Disease Virus 1 and 2. Exoticscon Virtual 2022.
> Contraception et stérilisation du furet
Hautot Sur Mer France
I- Introduction
Le choix du mode de stérilisation se fait selon l’examen clinique, l’environnement et les antécédents du patient ainsi que l’implication du propriétaire dans sa relation avec l’animal.
II- La reproduction du furet : rappels physiologiques
L’appareil reproducteur du mâle possède se compose d’un pénis avec un os pénien en forme de J, de deux testicules en position ventrale à l’anus comme chez le chat, et d’une seule glande accessoire : la prostate (Jekl 2017). Le mâle est mature sexuellement entre 6 et 8 mois et parfois avant (4 mois) si cela tombe au printemps. La saison de reproduction du mâle est de décembre à août (Lewington 2007, Jekl 2017, Turner 2018).
Chez les femelles, les ovaires sont dans une bourse ovarienne et attachés à la partie dorsale de l’abdomen par un ligament suspenseur en position caudale par rapport aux deux reins. Les deux longues cornes utérines fusionnent dans un corps utérin court avec un seul cervix : on parle d’utérus bicornu. L’urètre abouche à la fosse clitoridienne au planché du vagin (Jekl 2017). La maturité sexuelle est observée à partir de 4 mois au printemps sinon entre 6 et 8 mois. Le cycle est polyoestrien et saisonnier. La présence de ses hormones sexuelles chez le furet de compagnie peut engendrer des pathologies graves voir mortelles (Lewington 2007, Jekl 2017, Turner 2018).
III- La stérilisation chirurgicale du furet
1. Indications
a) Chez le mâle
Les pathologies de l’appareil reproducteur chez le mâle sont nombreuses. L’hermaphrodisme est rapporté. Parmi les autres anomalies congénitales, la cryptorchidie est décrite (0,75%) (Jekl 2017). Elle est l’absence d’un ou deux testicules apparents, ceux-ci pouvant être présents dans le canal inguinal ou dans l’abdomen. Tout furet porteur de cette affection doit être écarté de la reproduction. Une stérilisation chirurgicale est conseillée. Cette stérilisation est définitive et le testicule non descendu doit être retiré afin d’éviter qu’il n’évolue en processus néoplasique (Lewington 2007, Jekl 2017, Turner 2018).
Les traumatismes chez le furet peuvent aussi être à l’origine de nombreuses atteintes de l’appareil génital : orchite/épidydimite sur morsure, paraphymosis (Bulliot 2021), etc. (Lewington 2007, Jekl 2017, Turner 2018). Les tumeurs testiculaires (tumeurs de Leydig, sertolinome etc.) ne représentent que 1,1% des tumeurs chez le furet, métastasent rarement. Leur traitement est la castration chirurgicale (Lewington 2007, Jekl 2017, Turner 2018). Les tumeurs des glandes apocrines du prépuce (75% des néoplasies du prépuce) sont assez courantes et un lien avec les maladies surrénaliennes est suspecté (Jekl 2017).
Tout atteinte de l’appareil reproducteur nécessite une stérilisation chirurgicale car les organes pathologiques doivent être retirés. Chez le mâle, la technique d’orchidectomie est la même que chez le chat (Lewington 2007, Miwa 2016, Jekl 2017, Turner 2018).
b) Chez la femelle
La mise à la reproduction chez la furette est particulièrement éprouvante et la gestation chez la furette n’est pas sans risque : des toxémies de gestation en fin de gestation et parfois après la mise bas touchent 75% des femelles ayant huit petits. Les dystocies sont rares mais très dangereuses (Lewington 2007, Jekl 2017, Turner 2018). Cependant, les maladies de l’appareil reproducteur chez la furette sont nombreuses : pseudogestation et pseudoanémie, vaginite, hydromètre (Jekl 2006), endométrite (Antanov 2019), mucomètre, kystes ovariens, tumeur ovarienne, tumeur utérine comme le leyomyosarcome (rare, 2,3% des cancers chez le furet), hyperplasie glandulokystique, mammite aigue ou chronique. Toutes ces pathologies seront évitées par la stérilisation chirurgicale avec retrait des ovaires et/ou l’utérus (Lewington 2007, Eshar 2010, Miwa 2016, Jekl 2017, Turner 2018), intervention possible possible à partir de 6 mois.
La pathologie la plus fréquemment rencontrée chez la furette non stérilisée est l’intoxication aux œstrogènes. Les femelles non stérilisées et non mise à la reproduction montrent des signes d’anémie par hyperoestrogénisme. Cela concerne 50% des femelles à la reproduction et le taux de mortalité est de 40%. En effet, sur un cycle polyoestrien dont l’ovulation est induite par le coït, les femelles peuvent rester en chaleur toute la période de reproduction en l’absence de mâle. Une transfusion sanguine suivi d’une d’ovario-hystérectomie sont alors nécessaires (Lewington 2007, Eshar 2010, Jekl 2017, Turner 2018). Par conséquent la contraception est essentielle chez la furette.
Chez les deux sexes, la stérilisation chirurgicale favorise également la sociabilité avec les propriétaires et au sein d’un groupe.
2. Effets indésirables
La stérilisation chirurgicale est réalisée sous anesthésie générale (Eshar 2010). Le furet doit donc être en état de supporter cette intervention (Eshar 2010). Néanmoins, la stérilisation chirurgicale peut favoriser une autre affection très courante chez le furet : les tumeurs des surrénales.
Une fois le furet stérilisé chirurgicalement, l’absence des hormones sexuelles engendre un arrêt du rétrocontrôle négatif sur l’axe hypothalamus et hypophysaire. L’hypothalamus libère de manière continu la GnRH qui stimule à son tour la production de LH et FSH par l’hypophyse. Ces hormones ont des récepteurs dans la zone réticulée du cortex surrénalien. Cela engendre une production d’hormones sexuelles par le cortex surrénalien à l’origine des signes cliniques (Lewington 2007, Jekl 2017, Turner 2018).
Cette maladie apparaît en moyenne entre 3 et 4 ans après la stérilisation chirurgicale (Brandao 2022). Les signes cliniques sont une alopécie (90%) non prurigineuse bilatérale symétrique progressive (queue, lombes), parfois du prurit, peau fine et cartonnée, léthargie, une dysurie chez les mâles avec une maladie prostatique, un retour d’un comportement sexuel, de l’agressivité (Lewington 2007, Jekl 2017, Turner 2018, Brandao 2022). Chez la femelle, la vulve peut être œdémateuse (70%) et présenter des écoulements. Une seule surrénale est souvent augmentée de taille (85%) et est souvent la gauche. Mais cette affection peut parfois être bilatérale (19%) (Lewington 2007, Jekl 2017, Turner 2018, Brandao 2022). L’origine de la maladie surrénalienne, cependant, reste aujourd’hui encore un indéterminé. Plusieurs facteurs semblent être incriminés : âge, stérilisation, alimentation, génétique, et vie en intérieur. Le traitement hormonal est palliatif et peut échouer lors de carcinome par exemple (Lewington 2007, Jekl 2017, Turner 2018, Brandao 2022).
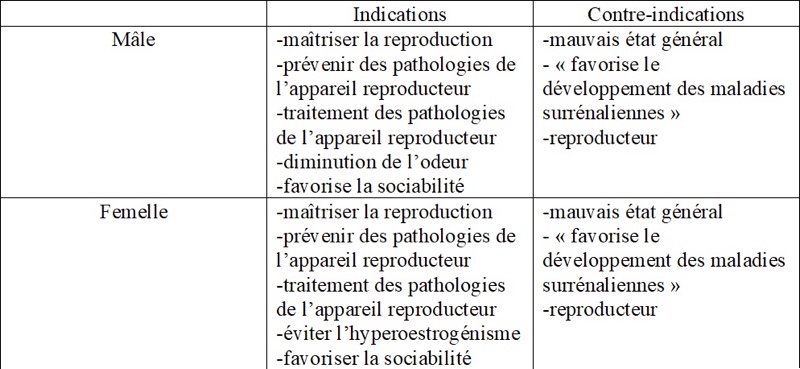
Tableau 1
IV- La stérilisation chimique du furet
1. Indication
La reproduction et les pathologies de l’appareil reproducteur du furet sont également évités par la stérilisation chimique. Toutes sauf les anomalies congénitales bien évidemment : hermaphrodisme, monorchidie, cryptorchidie qui doivent être explorées et prise en charge chirurgicalement (Lewington 2007, Jekl 2017, Turner 2018).
- La contraception du furet peut être obtenue par l'utilisation de progestatifs. Les agonistes de la GnRH inhibent la synthèse de la LH et de la FSH réduisant ainsi efficacement la production d'œstrogènes et d'androgènes et, dans le cas des femelles entières, empêchant la formation de follicules. En raison de l'inhibition de la libération de LH et de FSH les agonistes de la GnRH en dépôt (acétate de leuprolide, desloréline) sont largement utilisés dans la prévention et le traitement utilisé des maladies corticosurrénaliennes chez les furets (Jekl 2017).
- La pose d’un implant hormonal, un implant de desloréline, un supragoniste des récepteurs à la GnRh est plus pratique dans le temps. La pose de l’implant se fait à partir de la maturité sexuelle (4 – 8 mois) et permet une stérilisation chimique chez le mâle et la femelle d’un an et demi à deux ans pour l’implant de 4,7 mg (hors AMM) contre 16 mois à 4 ans pour l’implant de 9,4 mg (AMM furet). Il y a un temps de latence d’action de l’implant : 4 à 6 semaines pour le 4,7 mg et 5 à 14 semaines pour l’implant de 9,4 mg. L’implant doit être mis en place en dehors des périodes de chaleur ou dans les 15 premiers jours chez la femelle, en sous-cutanée entre les deux omoplates mais pas dans le tissu adipeux (Lewington 2007, Jekl 2017, Turner 2018). Comme l'implant de desloréline stimule d'abord la libération de FSH et de LH, il induit l'œstrus dans les 3 à 4 jours suivant le traitement. L'œstrus dure environ 10 jours et une pseudo-grossesse peut être observée (16% des cas) (Jekl 2017). Pour être sûr du stade des chaleurs, un examen cytologique vaginal peut être réalisé (Jekl 2017).
La contraception du furet permet à la fois de maîtriser la reproduction, d’éviter les pathologies de l’appareil reproducteur dues aux hormones sexuelles, tout en prévenant de la maladie surrénalienne. Elle est donc, si l’animal n’a aucune pathologie au moment de l’examen clinique, le mode de stérilisation de choix. Néanmoins, vu qu’elle est transitoire, elle nécessite une surveillance de l’animal surtout chez la furette qui pourrait développer un hyperoestrogénisme à la reprise du cycle reproducteur.
2. Contre-indications
Lorsque l’affection de l’appareil reproducteur est déjà présente : pyomètre, hyperoestrogénisme, tumeur testiculaire,... , l’implant de desloréline n’est pas conseillé. En effet, après la pose d’un implant et la gestion médicale de l’affection, la pathologie pourrait réapparaitre à l’arrêt des effets hormonaux. D’autres part, si l’affection reproductrice engendre un hyperoestrogénisme (kystes ovariens, néoplasie ovarienne, etc.) l’implant est déconseillé car il engendre dans les premiers temps une augmentation de ces hormones sexuelles et peut aggraver la situation. Une exploration de la pathologie (radiographie, échographie, bilan sanguin, etc.) et une stérilisation chirurgicale sont nécessaires pour une bonne prise en charge du patient (Lewington 2007, Jekl 2017, Turner 2018).
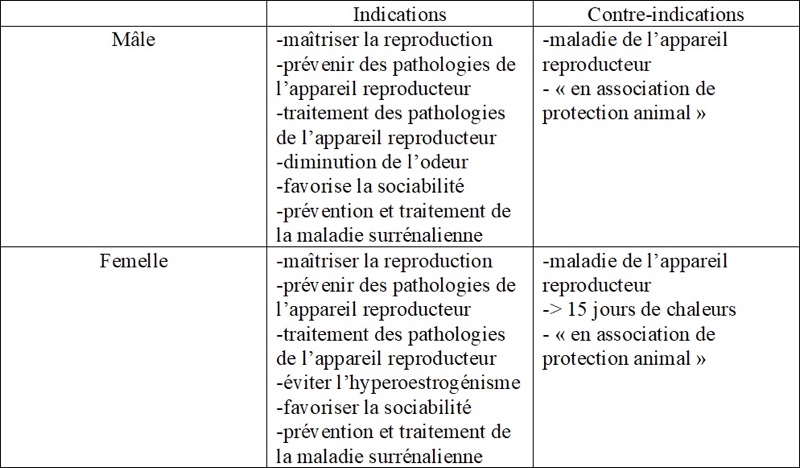
Tableau 2
V- Conclusion
Lors du bilan de santé du furet, si le patient est en bonne santé et ne présente aucun trouble de l’appareil reproducteur au moment de la consultation ni comme antécédent pathologique similaire, une contraception chimique par pose d’implant de desloréline est idéale afin d’éviter la maladie surrénalienne. Néanmoins, elle nécessite une surveillance du patient concernant la reprise du cycle hormonal et un renouvellement de l’implant selon sa durée.
Bibliographie
- Lennox et al. Comparison of 4,7 mg deslorelin implants and surgery for the treatment of adrenocorticol disease in ferets. Journal of Exotic Pets 2012.
- Jekl V, Hauptman K. Reproductive Medicine in Ferrets. Vet Clin Exot Anim. 2017 ; 20 : 629–663.
- Kuijten AM, Schoemaker NJ, Voorhout G. Ultrasonographic visualization of the adrenal glands of healthy ferrets and ferrets with hyperadrenocorticism. J Am Anim Hosp Assoc. 2007 ; 43(2) :78-84.
- Eshar D, Wyre NR. Ovariohysterectomy in ferrets. Lab Anim (NY). 2010 ;39(5) :140-1.
- Brandao J. Ferret endocrinology. Exoticscon. 2022.
> Malocclusion des incisives du lapin et du cobaye
Toulouse France
I- Introduction
Les maladies dentaires sont une affection courant chez les petits mammifères herbivores tels que le lapin, le cochon d’Inde (ou cobaye), le chinchilla et l’octodon. En effets, chez ces espèces, l’ensemble des dents poussent en continue tout au long de la vie de l’individu (dentition élodonte). Tout processus interférant avec la pousse ou l’usure dentaire peut entrainer le développement d’une malocclusion dentaire. La malocclusion des incisives d’origine primaire se développe de manière indépendante des modifications des dents jugales (prémolaires et molaires). Celle-ci peut être d’origine congénitale ou acquise (traumatisme, lésion douloureuse de la gencive…). Les rongeurs omnivores (rats, souris, hamsters) peuvent souffrir d’une malocclusion primaire des incisives en lien avec un environnement non adapté. Cette origine est particulièrement rare chez le lapin et les rongeurs herbivores.
II- Anatomie dentaire des incisives du lapin et du cobaye
Anatomiquement, les incisives des rongeurs et lapins sont similaires. La couche d'émail est beaucoup plus importante sur la face vestibulaire que sur les faces linguale ou palatine des incisives, en particulier au niveau des incisives maxillaires. Chez le lapin et le cobaye, contrairement aux Rongeurs, l’émail est constitué d’une seule couche. Cette répartition particulière de l’émail provoque une usure accrue de la surface palatine de l’incisive maxillaire, qui est constituée principalement de dentine plus molle, au contact du bord plus dur de l’incisive mandibulaire, ce qui permet la formation du bord incisif typique en forme de ciseau. Le lapin et le cobaye ont une coloration blanche de l’émail dentaire. En temps normal, la pointe des incisives mandibulaires s’appose juste derrière la première paire d’incisives maxillaires et contre la seconde paire d’incisives maxillaires. Les incisives mandibulaires s'usent à peu près à angle droit contre la deuxième paire d’incisives maxillaires, et la première paire d’incisives maxillaires s'usent le long de la courbure formée par les incisives mandibulaires. Le lapin appartient à l’ordre des Lagomorphes tandis que le cochon d’Inde appartient à l’ordre des Rongeurs. En effet, les rongeurs possèdent une paire bien développée d’incisives maxillaires et mandibulaires (simplicidentata), tandis que le lapin possède une seconde paire d’incisives maxillaires, de taille plus réduite, située en arrière de la première paire d’incisives maxillaires (duplicidentata).
III- Malocclusion des incisives d’origine congénitale
Les malformations congénitales peuvent toucher les incisives directement ou bien toucher la mâchoire (malformation du squelette) entrainant une malposition des incisives. Il y a peu de description de cas de malformations directement des incisives chez le lapin et le cochon d’Inde. Les malformations du squelette sont beaucoup plus fréquentes chez le lapin. La malformation congénitale la plus fréquente est le brachygnatisme maxillaire. Au contraire, les malocclusions congénitales de la mâchoire sont rares chez les rongeurs herbivores. Le brachygnatisme maxillaire correspond à un raccourcissement congénital du maxillaire où la courbure des incisives est normale. Il s’agit d’une anomalie héréditaire autosomal récessive où seul le diastème maxillaire ou la totalité de la tête est raccourci. Cette malformation est généralement observable à partir de l’âge de 3 semaines. Le signe clinique typique observable relativement tôt est un contact anormal entre les incisives maxillaires et mandibulaires. Généralement, dans la phase initiale de cette malocclusion, les lapins ne présentent aucuns symptômes. La pousse excessive des incisives finit par gêner l’ouverture de la cavité buccale altérant la prise alimentaire normale du lapin.
Le brachygnathisme maxillaire affecte principalement les races naines pesant moins de 1,5 kg, ainsi que les lapins béliers nains. Cette affection est très répandue parmi la population de lapin de compagnie en raison de leur popularité d’aspect « mignon » de leur petite tête ronde. En raison d’une mauvaise apposition des incisives, les incisives maxillaires s’incurvent progressivement et fortement vers l’intérieur de la cavité buccale. Ceci peut entrainer des lésions de la muqueuse orale. Dans certains cas, une courbure extrême des incisives maxillaires est observée, entrainant des lésions du palais. Au contraire, l’incurvation des incisives mandibulaires est moins prononcée. Celles-ci deviennent particulièrement longue rostro-dorsalement donnant un aspect de défense d’éléphant. Plus le temps avance et plus il y a un risque de développement secondaire d’une malocclusion des dents jugales (en lien avec une pression d’occlusion anormale constante des incisives).
Une autre complication associée lors de malocclusion des incisives est le déplacement rétrograde des incisives maxillaires responsables d’une obstruction du conduit naso-lacrymal. Le développement d’abcès dentaires est également possible. Le plus tôt le brachygnathisme maxillaire est identifié et meilleur est le pronostic que le long terme (avant le développement d’une malocclusion secondaire des dents jugales). Il existe deux options pour la gestion d’une malocclusion des incisives d’origine congénitale. Soit le limage régulier des incisives (avec un disque diamanté et surtout pas une pince), soit l’extraction totale des incisives le plus tôt possible. La deuxième option est celle à favoriser. Chez le lapin avec des dents jugales saines, les incisives en malocclusion ont besoin d’être limées toutes les 4 à 6 semaines tout au long de la vie de l’individu. Ceci est variable selon que les incisives sont toujours partiellement en contact ou non les unes avec les autres. Lors de l’extraction des incisives, il est important de bien retirer l’ensemble de la dent ainsi que le bourgeon germinal à l’apex afin de prévenir du risque de repousse dentaire. Après l’extraction des incisives, le lapin est capable de s’alimenter normalement mais leur nourriture doit être coupé en plus petits morceaux. La préhension alimentaire est réalisée par les lèvres puis la mastication s’effectue au niveau des dents jugales. Il est important cependant de noter que l’extraction totale des incisives dans le cas de brachygnathisme ne garanti pas que l’occlusion des dents jugales restent normales par la suite (en raison du défaut de conformation congénitale du crâne). Cependant, le risque de développement d’une malocclusion secondaire des dents jugales est significativement plus élevé lors de limage des incisives répété que lors d’une extraction totale des incisives.
Lors que le retrait des incisives s’effectue tardivement, après déjà la réalisation de nombreux limages des incisives, l’extraction des incisives est plus délicate. Ceci est du aux anomalies de la structures intra-alvéolaire de la dent et il n’est pas rare d’avoir des complications post-opératoires. Il y a généralement un risque d’infection intra-alvéolaire ou de nécrose partielle de l’os alvéolaire avec des retards de cicatrisation.
IV- Malocclusion des incisives d’origine traumatique
Un traumatisme direct comme une chute, peut entrainer une fracture de la couronne d’une ou plusieurs incisives. Dans la plupart des cas où l’animal tombe la tête la première sur une surface dure, il peut également y avoir des lésions de la portion rostrale de la mâchoire. De l’imagerie médicale est importante afin d’évaluer les différentes lésions osseuses avant l’instauration du traitement dentaire. Lors d’une fracture dentaire, il est important d’évaluer s’il y a ou non une exposition de la pulpe dentaire. Si les cellules germinales de l’apex sont partiellement ou complètement détruites, soit l’incisive ne repoussera pas, soit la structure de celle-ci sera altérée. Lors d’une fracture d’une incisive, l’incisive opposée n’est plus en contact entrainant une élongation anormale de celle-ci. Un limage temporaire de cette dent est nécessaire le temps que la dent fracturée repousse normalement afin de retrouver une occlusion normale des incisives (cela prend généralement 3 à 6 semaines). Selon le type de fracture d’incisive, les incisives sont limées à la même hauteur que celle fracturée juste après le trauma, afin de limiter les limages répétés. Le temps de la repousse dentaire, une adaptation de l’alimentation est à prévoir avec des aliments en petits morceaux pour favoriser la prise alimentaire.
V- Malocclusion des incisives d’origine secondaire
L’affection des incisives la plus fréquente chez le lapin ainsi que chez les rongeurs herbivores est la malocclusion acquise secondaire des incisives, suite à une affection des dents jugales. Lors d’une élongation importante des dents jugales, les mâchoires sont écartées les unes des autres entrainant une malocclusion secondaire des incisives. Lentement, les incisives sont modifiées structurellement, en longueur et forme. Souvent, les incisives sont de différentes longueurs et sont anormalement incurvées. De plus, elles sont souvent des rainures transversales et une décoloration, indiquant une irritation de l’apex. Lors d’une malocclusion des incisives chez le cochon d’Inde, le pattern de malocclusion est différent de celui du lapin. En effet, contrairement au lapin, il n’y a pas d’incurvation des incisives maxillaires mais plutôt une déviation latérale. La cause la plus importante de malocclusion des dents jugales chez le lapin et les rongeurs herbivores est le défaut de fibres dans la ration alimentaire. L’apport de fibre est indispensable dans la ration alimentaire du lapin afin de favoriser l’usure dentaire.
Chez le cochon d’Inde, une carence en vitamine C joue un rôle dans le développement de malocclusion des incisives. La complémentation en vitamine C est importante chez le cochon d’Inde. Dans ces cas, de l’imagerie médicale est importante afin d’évaluer l’ensemble des dents. Un limage uniquement des incisives ne résoudra pas le problème et il est important de prendre en charge l’affection des dents jugales. En cas d’infection péri-apicale, une extraction dentaire est indiquée. Lors d’extraction totale des incisives dans le cas d’une origine secondaire par malocclusion des dents jugales, le taux de complications est plus important (retard de cicatrisation, infection post-opératoire). Dans ces cas, le limage régulier des incisives est souvent préféré. Les incisives doivent être limées à l’aide d’un disque diamanté et ne doit surtout pas être coupées à la pince car cela douloureux et prédispose au développement d’abcès dentaires.
VI- Conclusion
Chez le lapin et le cobaye, l’ensemble des dents poussent en continu tout au long de la vie de l’individu. Lors d’une malocclusion des incisives, l’origine principale est secondaire suite à une malocclusion des dents jugales en lien avec une alimentation pauvre en fibres. Dans ces cas, il est important d’évaluer la totalité de la cavité buccale afin d’identifier les anomalies des dents jugales. Les incisives doivent être limées à l’aide d’un disque diamanté et ne doit surtout pas être coupées à la pince. Chez le lapin de compagnie, les races brachycéphales sont populaires. Cependant, ces races sont prédisposées aux malocclusions des incisives d’origine congénitale. Lors de malocclusion congénitale des incisives, une extraction totale des incisives est recommandée le plus tôt possible.
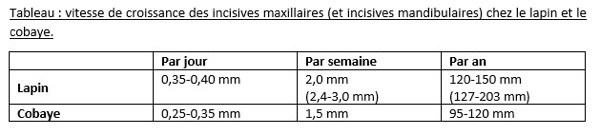
Tableau 1
Bibliographie
- Böhmer E. Dentistry in rabbits and rodents. Wiley Blackwell ; 2015
- Legendre L. Anatomy and Disorders of the Oral Cavity of Guinea Pigs. Vet Clin North Am Exotic. 2016 ; 19(3) : 825-42.
> Rhinite du jeune lapin
Toulouse France
I- Introduction
Les rhinites représentent un motif de consultation relativement fréquent chez le jeune lapin. Les signes cliniques généralement observés sont un jetage nasal et des éternuements. Les races naines brachycéphales (notamment les béliers nains) sont très populaires en tant que lapins de compagnie en raison de leur conformation ronde de la tête. Cependant, ces races brachycéphales sont prédisposées au développement de maladie dentaire et d’affection respiratoire supérieure en raison de cavités nasales beaucoup plus courtes.
II- Anatomie du haut appareil respiratoire du lapin
Le lapin ne respire que par le nez. En effet, l’épiglotte des lapins est longue et engagée au-dessus de la marge caudale du palais mou. Les cavités nasales sont constituées de trois cornets nasaux qui délimitent les méats ventral, moyen, dorsal et commun. Le méat ventral se trouve dans la continuité du rhinopharynx. Le lapin possède des cavités paranasales paires et symétriques : sinus conchal dorsal, le sinus maxillaire (composé d’une cavité dorsale et ventrale connectées caudalement par une ouverture large) et le sinus sphénoïdal. La cavité conchomaxillaire (sinus conchal + maxillaire) s’abouche dans la cavité nasale par une seule ouverte en forme de fente rendant cette cavité sensible au modifications pathologiques (infections bactériennes). Le conduit nasolacrimal est étroitement associé aux cavités nasales. Les cavités nasales sont également connectées aux bulles tympaniques via le méat nasopharyngé et la trompe d’Eustache.
III- Rhinites d’origine infectieuse
Les rhinites infectieuses sont majoritairement d’origine bactérienne. Les affections virales, fongiques et parasitaires sont plus rares. En raison de l’anatomie particulière des cavités nasales et paranasales, le lapin est un modèle expérimental pour les rhinites et les sinusites. En effet, une « sinusite » peut se développer suite à une occlusion mécanique de l’ouverture entre les cavités nasales et la cavité conchomaxillaire. En raison de l’association étroite entre cavités nasales et bulles tympaniques, une rhinite infectieuse peut secondairement entrainer une otite moyenne et inversement. Une étude menée chez 108 lapins sains rapporte la prévalence de différentes bactéries dans des écouvillons nasaux profonds. On note une forte incidence de Staphylococcus aureus à coagulase positive (100%), potentiellement pathogènes et d’intérêt pour la santé publique. Il existe en effet une corrélation entre la production de coagulase et la pathogénicité de la souche bactérienne. Les Enterobacteriacea (Klebsiella pneumoniae à 10,2% et Escherichia coli à 5,3%) sont les deuxièmes germes les plus fréquents, sans association avec des signes d’entérite, et potentiellement en relation avec la coprophagie. Pasteurella multocida est généralement exposée comme étant la cause la plus importante de maladie respiratoire chez le lapin, cependant, d’autres pathogènes sont également à prendre en considération. D’après une étude réalisée chez 121 lapins présentant des signes cliniques respiratoires, les bactéries les plus fréquemment isolées sont Pasteurella multocida (55%), Bordetella bronchiseptica (52%), Pseudomonas spp. (28%) et Staphylococcus spp. (17%). Des infections mixtes sont relativement fréquentes avec une association de P. multocida et de B. bronchiseptica dans 29% des cas. La majorité des échantillons contienne une combinaison de 2 à 3 souches bactériennes pathogènes.
Une seconde étude se concentre sur l’investigation de la transmission des infections à P. multocida et B. bronchiseptica. Un écouvillon nasal profond est obtenu chez la mère et deux lapereaux (4-6 semaines d’âge) dans des portées présentant des signes de maladie respiratoire haute. Parmi les lapereaux pré-sevrage présentant des symptômes, ceux présentant une infection à P. multocida ou B. bronchiseptica sont plus susceptibles d’avoir une mère présentant la même infection. A deux mois post-sevrage, environ 50% des lapins présentant une infection à P. multocida ou P. multocida + B. bronchiseptica ont développé des signes cliniques d’infection des voies respiratoires supérieures, tandis que les lapins présentant une infection à B. bronchiseptica seule n’ont quasiment pas développé de signes cliniques. Les lapins atteints d’une rhinite à P. multocida présentent souvent une infection concomitante des cavités paranasales et de l’oreille moyenne. B. bronchiseptica adhère préférentiellement aux cellules ciliées, provoquant une résistance à l’évacuation des voies respiratoires, possible ciliostase favorisant l’adhésion de P. multocida. Aucune relation n’est observée entre les niveaux d’IgG et l’infection à P. multocida chez les lapereaux au sevrage, ce qui dénote une absence d’effet protecteur des anticorps maternels. P. multocida est particulièrement prévalent. L’expression clinique fait généralement suite à un stress, notamment lors du sevrage, du transport et du changement brutal d’environnement suite à l’adoption du jeune lapin. De plus, un environnement poussiéreux, souillés et des problèmes de ventilation peuvent également entrainer l’expression clinique respiratoire. Les souches de Pasteurella varient grandement en termes de virulence.
En dehors de la myxomatose, les pathogènes virales produisant une atteinte primaire des voies respiratoires supérieurs sont rares.
IV- Rhinites d’origine non-infectieuse
Une rhinite est également possible suite à un traumatisme de la face. Certaines maladies dentaires, tout particulièrement une malocclusion des incisives, peuvent entrainer des signes respiratoires. Les racines dentaires des premières dents jugales se trouvant à proximité des cavités nasales, une affection de ces racines peut provoquer du jetage et de l’épiphora, voire une rhinite chronique et un possible empyème des récessus, notamment le récessus maxillaire.
V- Examens complémentaires
L’imagerie médicale et tout particulièrement le scanner sont important pour explorer les cavités nasales, paranasales, bulles tympaniques et dentition. Cet examen est fortement recommandé lors de rhinite chronique de répondant pas aux traitements. Une analyse bactériologique soit sur lavage nasal ou écouvillon nasal profond est fortement indiqué afin d’identifier le germe en cause et de cibler au mieux le traitement antibiotique.
VI- Traitement
Lors de rhinite bactérienne, la réalisation d’une bactériologie et antibiogramme sont important afin d’identifier et germe en cause et d’adapter le traitement ce qui augmente les chances de réussite du traitement antibiotique. Il est important de prendre de choisir un antibiotique adapté au lapin et de ne pas utiliser des molécules responsables de dysbiose intestinale pouvant entrainer une entérotoxémie fatale (ex : amoxicilline, pénicillines par voie orale, érythromycine…). Tous les antibiotiques se révèlent très actifs contre P. multocida, tandis que B. bronchiseptica et Pseudomonas spp. sont plus résistantes. La marbofloxacine est probablement la meilleure option pour cibler toutes les bactéries, et son efficacité semble supérieure aux autres fluoroquinolones. Lors d’infection à P. multocida, la mise en place du traitement dans les cas récents est associée à de meilleure chance de réussite du traitement. Cependant, le pronostic sur le long terme est faible dans le cas des infections chroniques avec des taux importants de récidives lors d’arrêt du traitement. Des études ont montré l’utilisation efficace d’enrofloxacine (5-10 mg/kg PO q12h) ou de chloramphénicol (50mg/kg PO q12h) pendant 2 à 3 mois pour la gestion de cas chroniques d’infection à P. multocida. L’utilisation de nébulisation avec un soluté isotonique peut être une aide dans le traitement en réhydratant l’escalator mucociliaire.
Lors d’infection importante (granulome, ne répondant pas au traitement médical) des cavités nasales ou paranasales, une prise en charge chirurgicale (rhinotomie/pararhinotomie) est souvent indiquée afin de réaliser un débridement chirurgical de l’infection. D’après une étude avec le lapin en modèle expérimental pour évaluer le laser thérapeutique dans la gestion de rhinosinusite bactérienne aigue, le taux bactérien est réduit jusqu’à 99 ,9% après le traitement.
VII- Conclusion
Une part importante dans les prévention et gestion des rhinites chez le lapin passe par un environnement optimal (alimentation, logement, diminution du stress, hygiène). Il est important de prendre en charge le plus rapidement possible les rhinites du lapin afin de traiter rapidement et d’éviter tout chronicité sur le long terme.
Bibliographie
- Lennox AM et coll. Respiratory disease and pasteurellosis. In: Quesenberry KE, eds. Ferrets, Rabbits, and Rodents: Clinical Medicine and Surgery. 4th ed. St. Louis: WB Saunders ; 2021 : 188-200.
- Ajuwape TP, Aregbesola EA. The bacterial flora of the upper respiratory tract of normal rabbits. Isr J Vet Med 2002 ; 57 : 121-123.
- Rougier S et coll. Epidemiology and susceptibility of pathogenic bacteria responsible for upper respiratory tract infections in pet rabbits. Vet Microbiol 2006 ; 115 : 192–198.
- Deeb BJ, DiGiacomo RF, Bernard BL, et al. Pasteurella multocida and Bordetella bronchiseptica infections in rabbits. J Clin Microbiol 1990 ; 28 : 70–75.
- Krespi YP et coll. Laser-induced microbial reduction in acute bacterial rhinosinusitis. Am J Rhinol Allergy. 2009 ; 23(6) : 29-32.
