> Conjonctivites félines : diagnostic différentiel, traitement
Maisons-Alfort France
I- Introduction
Le terme de conjonctivite correspond à une atteinte inflammatoire de la conjonctive, tunique de l’œil qui tapisse la face interne des paupières, recouvre la membrane nictitante et se réfléchit sur le bulbe jusqu’au limbe.
L’origine d’une conjonctivite est variée (traumatique, corps étranger, allergique,…), mais dans l’espèce féline, notamment chez le jeune chat, l’origine infectieuse est prédominante.[1] Différents agents pathogènes ont été incriminés dans les conjonctivites félines, cet exposé se limitera aux agents suivants : Chlamydia felis, Herpesvirus félin de type 1, Calicivirus, Mycoplasma felis.
II- Sémiologie
Les conjonctivites se manifestent par :
- des signes de douleur généralement plus marqués dans les atteintes aiguës : blépharospasme (Figure 1), photophobie, prurit oculaire, et des sécrétions oculaires anomales un larmoiement est observé dans les stades débutants des conjonctivites virales (Herpesvirose, Figure 2)
- des sécrétions mucopurulentes sont observées lors de conjonctivites bactériennes (chlamydiose)
- une hyperhémie et un œdème conjonctival (chémosis) (Figure 2).

Figure 1 : Conjonctivite aiguë bilatérale chez un chat : on observe un blépharospasme complet à droit, partiel avec une procidence de la membrane nictitante à gauche. (Crédit : Sabine Chahory, Service d’ophtalmologie du ChuvA)
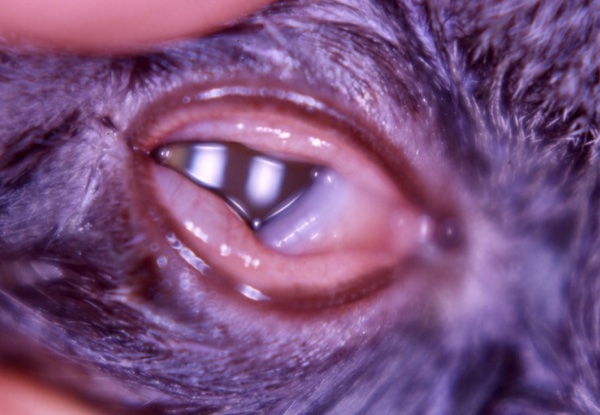
Figure 2 : Sécrétions séreuses et chémosis chez un chaton atteint d’une forme aiguë d’herpesvirose. (Crédit : Sabine Chahory, Service d’ophtalmologie du ChuvA)
III- Diagnostic différentiel
1. Les principales causes de conjonctivites infectieuses félines [1,2]
a) Chlamydiose
Maladie bactérienne due à une infection par Chlamydia felis. Les signes de conjonctivite sont très marqués dans les stades aigus : des sécrétions d’abord séreuses, puis rapidement purulentes, avec une atteinte d’abord unilatérale puis après plusieurs jours d’évolution, bilatérale : un chémosis marqué est assez caractéristique. Le pronostic est généralement bon, avec une évolution favorable suite à une antibiothérapie adéquate. Le diagnostic étiologique peut être confirmé par une analyse cytologique sur un frottis conjonctival ou une analyse par PCR (Polymerase Chain Reaction).
b) Herpesvirose (FHV-1)
Maladie fréquente chez le jeune chat, due à une infection par l’Herpesvirus félin de type I. Les signes oculaires sont souvent associés à une atteinte des voies respiratoires supérieures (coryza contagieux) et de l’état général (hyperthermie) dans sa forme aiguë. On distingue deux formes cliniques :
- chez le jeune chat, on observe une infection primaire qui se manifeste par un écoulement séreux oculaire (qui devient mucopurulent) pendant 15 jours, associé à une hyperhémie conjonctivale. Le chémosis est variable ; l’atteinte est souvent bilatérale, associée à des éternuements et un jetage nasal (rhinotrachéite) ; l’atteinte cornéenne est très caractéristique de la maladie oculaire avec, soit des ulcères dendritiques, soit des ulcères en carte de géographie. L’évolution se fait vers une guérison spontanée en 2 à 3 semaines, mais des complications (symblépharon, ulcères cornéens, kératoconjonctivite sèche) peuvent survenir. Environ 80% des chats atteints restent porteurs latents : le virus reste à l’état quiescent dans la cornée et dans les ganglions du nerf trijumeau. Cette phase de latence ne s’accompagne d’aucun signe clinique ni d’excrétion virale, mais le virus peut se réactiver chez 50 % des sujets : ceci constitue l’infection secondaire, qui est favorisée par le stress, les maladies intercurrentes ou une corticothérapie prolongée.
- chez le chat adulte, les signes cliniques d’une infection secondaire sont dominés par une atteinte oculaire le plus souvent unilatérale, sans signe de rhinite. Le tableau clinique peut être soit une conjonctivite chronique (hyperhémie conjonctivale, écoulement muqueux, marron) isolée, récurrente, soit une kératite ulcéreuse récidivante. Les signes évoluent fréquemment sous forme récurrente, à l’occasion d’un stress, et peuvent durer plusieurs mois.
Le diagnostic peut être établi par analyse PCR sur prélèvement conjonctival et/ou cornéen.
c) Calicivirose
Le calicivirus est majoritairement à l’origine de rhinotrachéite et de stomatogingivite, mais il est moins pathogène pour les surfaces oculaires. Il peut être à l’origine d’une conjonctivite érosive, sans atteinte cornéenne, mais surtout dans un contexte de comorbidités. Actuellement, nous considérons que le calicivirus est très peu probablement impliqué dans les conjonctivites isolées sans signes de stomatogingivite associés. Le diagnostic peut être établi par analyse PCR sur prélèvement conjonctival ou buccal.
d) Mycoplasmose
Maladie moins fréquente, due à Mycoplasma félis et M. gatae. Les mycoplasmes ont longtemps été considérés comme des agents potentiels de conjonctivite féline, mais la présence de ces organismes commensaux dans la conjonctive ou les voies respiratoires supérieures des chats doit nous amener à considérer que leur rôle dans les conjonctivites félines est secondaire, dans un contexte d’immunodépression ou de comorbidités. Les signes cliniques incluent un écoulement séreux à mucopurulent, une conjonctivite uni- ou bilatérale, une hypertrophie papillaire, un chémosis, associés à la présence de pseudo-membranes dans les fornix. Il est décrit que le diagnostic peut être établi par isolement des mycoplasmes sur frottis conjonctival (petites inclusions basophiles (coccoïdes), bleues claires, au niveau de la membrane des cellules épithéliales), mais la petite taille des inclusions rend ce diagnostic très incertain. La recherche par PCR sur prélèvement oculaire est envisageable mais l’intérêt clinique d’un résultat positif n’est pas clairement déterminé.
e) Les méthodes de diagnostic
Lors de suspicion d’une conjonctivite d’origine infectieuse chez un chat, un frottis conjonctival (ou cornéen en cas d’atteinte cornéenne) après instillation d’un anesthésique topique (Tétracaïne collyre®) peut être réalisé en vue :
- d’une analyse cytologique :
- Chlamydiose : la mise en évidence de corps d’inclusion intracytoplasmiques basophiles dans les cellules épithéliales est conclusive. L’absence d’inclusions ne permet pas d’écarter l’hypothèse d’une chlamydiose. Cette recherche est intéressante dans les formes aigues chez le chaton, cependant la période de plus forte probabilité d’observer ces inclusions reste limitée : entre 2 à 9 jours après l’apparition des signes cliniques. Dans les formes chroniques, les inclusions ne sont pas présentes, ce qui limite l’intérêt du frottis conjonctival. L’analyse cytologique révèle également de nombreux polynucléaires neutrophiles au début de l’infection puis devient moins spécifiques après le 15ème jour (neutrophiles, macrophages et lymphocytes). [1]
- Herpesvirose : des inclusions virales nucléaires sont décrites mais rarement observées. [2]
- d’une recherche d’agents infectieux par PCR :
- Chlamydiose : les résultats peuvent être faussés par les traitements antérieurs : une antibiothérapie augmente le risque de résultats négatifs. Par ailleurs, l’analyse par PCR est positive sur un faible nombre de chats sains. De même une vaccination antérieure au prélèvement peut donner un résultat positif. [1]
- Herpesvirose : l’intérêt d’une analyse par PCR doit prendre en compte différents facteurs : lors d’infection aiguë primaire du jeune chat, l’excrétion virale est importante, ce qui augmente les chances d’obtenir un résultat positif. Cependant, les signes cliniques sont souvent très évocateurs et ont tendance à régresser spontanément en quelques jours, ce qui limite l’intérêt de l’analyse. Cette recherche par PCR semblerait plus informative dans les formes chroniques lors de récidive de la primo-infection, mais dans ce cas, l’excrétion virale est très variable, ce qui augmente le risque d’obtenir un résultat négatif, qui ne sera pas conclusif. Par ailleurs, de nombreux chats cliniquement sains présentent une analyse par PCR positive sur prélèvement oculaire. [1] Tous ces éléments nous incitent à considérer l’intérêt d’une analyse par PCR sur des cas isolés avec beaucoup de précaution. Cette démarche est différente dans un contexte d’élevage, notamment lors de l’introduction d’un nouveau chat dans un effectif apparemment sain. La contagiosité de l’herpesvirus félin justifie les analyses par PCR dans ce contexte.
III- Prise en charge thérapeutique
1. Chlamydiose
Une antibiothérapie systémique doit être privilégiée, avec en première intention des tétracyclines : doxycycline 5 mg/kg BID pendant 3-4 semaines. L’association amoxicilline-acide clavulanique est également efficace. Par voie topique, la chlortétracycline en gel ou le chloramphénicol en pommade sont indiqués. Les signes cliniques régressent généralement en une semaine mais le traitement doit être poursuivi pendant 3 semaines à 1 mois. (3)
2. Herpesvirose
Le traitement des formes aiguës, ulcéreuses, nécessite une thérapie antivirale associée à une antibiothérapie topique à large spectre pour limiter les infections secondaires. L’efficacité du traitement antiviral est sujet à discussion. Les résultats des études cliniques ne sont pas toujours concordants. Actuellement, il n’existe pas d’antiviraux spécifiques de l’herpesvirus félin. Des antiviraux spécifiques de l’herpesvirus humain, disponibles en France, hors AMM (prescrits dans le cadre de la cascade pharmacologique), peuvent être administrés par voie topique ou systémique : Trifluridine (VIROPHTA collyre®), Ganciclovir (VIRGAN gel ophtalmique®) ; Famciclovir par voie orale (ORAVIR comprimés à 125 mg®): 1/4 à 1/2 cpé à 125 mg, BID pour un chat de 6 kg pdt 3 semaines. Une étude a montré l’efficacité et l’absence d’effets indésirables chez des chats infectés expérimentalement d’un traitement de famciclovir à 90 mg/kg, 3 fois par jour, pdt 21 jours. [4] Les antiviraux ayant une activité virostatique, leur durée de traitement est au minimum de deux semaines et doit être poursuivie une semaine après la guérison clinique.
3. Mycoplasmose
Les tétracyclines et le chloramphénicol sont efficaces. La guérison est attendue en 1 semaine. [3]
IV- Conclusion
Le diagnostic d’une conjonctivite infectieuse chez le jeune chat est un défi pour le clinicien. Les analyses par PCR représentent des méthodes de diagnostic aisément accessibles mais dont les résultats doivent être interprétés à la lumière des signes cliniques et du statut du patient.
Bibliographie
- Glaze MB. Feline Ophthalmology. In: Veterinary Ophthalmology, edited by KN Gelatt. Blackwell Wiley. 2021. p. 1665-840.
- Gould D, Dewhurst E, Papasouliotis K. Clinical microbiology and parasitology. In: Veterinary Ophthalmology Edited by Gelatt KN, Ben-Shlomo G, Gilger BG, Hendrix DVH, Kern TJ, Plummer CE. 6th éd. Hoboken (USA): John Wiley&Sons; 2021. p. 293-348.
- Webb A A, Cullen C L. Ocular manifestations of systemic diseases. The cat. In: Veterinary Ophthalmology, edited by KN Gelatt. Wiley Blackwell. 2021. p. 2421-94.
- Thomasy SM, Lim CC, Reilly CM, Kass PH, Lappin MR, Maggs DJ. Evaluation of orally administered famciclovir in cats experimentally infected with feline herpesvirus type-1. Am J Vet Res. janv 2011;72(1):85-95.
> Kératite herpétique : un défi diagnostic et thérapeutique
Nantes France
I- Introduction
L'herpèsvirus félin 1 (FHV-1) est un membre de la sous-famille des Alphaherpesvirinae. Le FHV-1 est une cause importante de maladie clinique dans la population féline mondiale. Les études sérologiques montrent que le FHV-1 est largement répandu dans la population féline, avec des taux d'exposition allant jusqu'à 97%.
À la suite d'une exposition au virus, la quasi-totalité des chats deviennent infectés de manière persistante et environ la moitié développeront une ou plusieurs récidives au cours de leur vie.
II - Signes cliniques
1. Primo-infection
La primo-infection survient le plus souvent chez les chatons et les chats adolescents, lorsque les anticorps maternels diminuent à partir de l'âge de 8 semaines environ. Cependant, même les chats vaccinés restent exposés à un certain risque, car les vaccins contre le FHV-1, qu'ils soient parentéraux ou intranasaux, ne confèrent qu'une immunité partielle contre les signes cliniques et aucune protection contre la réactivation/les excrétions. Les chats sont infectés après un contact direct ou indirect avec des animaux malades ou porteurs.
Les signes cliniques oculaires se développent 2 à 6 jours après l'infection. Cliniquement cette phase se manifeste par des signes de douleur oculaire (blépharospasme, prurit oculaire), et des signes oculaires associés à une conjonctivite aiguë (sécrétions oculaires, ulcération conjonctivale avec dans les cas les plus sévère formation d’un exsudat fibrineux sur la surface conjonctivale, hyperhémie conjonctivale, chémosis). Une atteinte cornéenne est également très fréquente. Elle est caractérisée par une kératite épithéliale ulcérative avec la formation d'ulcères épithéliaux ponctués et dendritiques pouvant évoluer en ulcère superficiel en carte de géographie. Dans certains cas une surinfection bactérienne est notée avec complication de l’ulcère superficiel en ulcère à collagénase voire en perforation cornéenne. Ces symptômes de primo-infection sont généralement d’autant plus sévères que l’animal est jeune. Les lésions se limitent d’elles-mêmes en 10 à 20 jours.
Si suite aux des effets cytolytiques du FHV-1 deux surfaces conjonctivales, ou une surface conjonctivale et une surface cornéenne ulcérées, se retrouvent en contact, la formation d'adhérences cicatricielles entre ces tissus est alors possible (symblépharons).
2. Récurrence
Après l’épisode de primo-infection, le virus remonte ensuite par les axones des neurones sensoriels jusqu'au ganglion trigéminal pour y établir une latence à vie. Cette latence est définie comme un état dans lequel le virus ne peut pas être cultivé (c'est-à-dire une infection non productive), et il n'y a pas de maladie clinique. Environ 80% des chats restent infectés de manière latente et deviennent alors porteur asymptomatique non excréteur. Une réactivation est cependant possible suite à un épisode de stress induit par un déménagement, une maladie intercurrente, l’introduction d’un nouvel animal au domicile, une mise bas, ou induite par une corticothérapie systémique. Pour certains chats, la cause de réactivation reste inconnue.
Lors d’une réactivation herpétique, deux mécanismes pathologiques peuvent apparaitre.
- Le premier mécanisme, similaire à la primo-infection mais en sévérité moindre. Cliniquement, on observe le plus fréquemment une conjonctivite unilatérale ou bilatérale, éventuellement associée à une kératite épithéliale ulcérative superficielle avec ou sans atteinte des voies respiratoires.
- Le second mécanisme est l’installation d’une réaction immunitaire (inefficace) à l'antigène viral à l’origine d’une kératite stromale métaherpétique (non ulcérative). Elle peut être une source de douleur chronique et peut également entraîner une fibrose cornéenne marquée.
III- Examens complémentaires
Différents examens complémentaires sont à notre disposition pour le diagnostic d’une kératite herpétique, cependant la question réside sur la nécessité ou non de réaliser ces examens complémentaires.
1. PCR
Il existe un paradoxe majeur en ce qui concerne le diagnostic du FHV-1. Les chats atteints d'une infection primaire par le FHV-1 excrètent le virus en quantités suffisantes pour que la détection virale soit relativement aisée. Cependant, les signes cliniques au cours de cette phase de l'infection ont tendance à être caractéristiques et à s'atténuer d'eux-mêmes, ce qui rend le diagnostic définitif moins nécessaire.
A contrario, lors d’atteintes chroniques associées au FHV-1, la diversité et l'ambiguïté des signes cliniques rendent l'identification virale plus souhaitable, en particulier si un traitement antiviral spécifique est envisagé. Cependant, la nature insaisissable du virus dans ces syndromes chroniques rend cette identification difficile.
Bien que la spécificité et l'extrême sensibilité de la PCR aient amélioré la détection du virus, de nombreux faux négatifs sont à déplorer notamment lors de la phase de latence, lié à une excrétion virale intermittente par les chats infectés ou lié à des erreurs techniques de prélèvement ou d’analyse.
La présence de faux positif est également possible : les chats cliniquement sains peuvent excréter le virus en réponse à un stress pharmacologique ou physiologique et peuvent héberger le virus dans la cornée et la conjonctive. Il est également prouvé que le virus vaccinal peut lui-même devenir latent dans les ganglions trigéminés et être réactivé à partir de ceux-ci ; comme les tests PCR sont incapables de différencier le virus vaccinal du virus sauvage, il est possible qu'un résultat PCR positif reflète le virus vaccinal plutôt que le virus sauvage.
Donc en cas de résultats positif chez un chat malade suite à un test PCR, 4 hypothèses sont possibles.
- La présence du virud est fortuite (c'est-à-dire sans rapport avec le processus pathologique primaire).
- Sa présence est une conséquence du processus pathologique primaire
- Il s'agit d'un virus vaccinal.
- Le virus est la cause du processus pathologique primaire.
Par conséquent, que le virus soit détecté ou non (c'est-à-dire indépendamment du résultat du test PCR), le clinicien doit toujours décider si un traitement antiviral spécifique est justifié en se basant sur sa suspicion clinique.
2. Autres examens complémentaires
L’analyse cytologique révèle généralement une inflammation neutrophile prédominante mais n’est pas pathognomonique du FHV-1, car les inclusions intranucléaires sont peu fréquentes.
La recherche d'anticorps fluorescents peut être effectuée sur du tissu conjonctival ou cornéen avant instillation de fluorescéine. Les tests d'anticorps fluorescents ont été largement remplacés par les tests d'isolement du virus et de PCR, bien que certains laboratoires de diagnostic proposent encore ce service.
Isolement du virus sur un prélèvement conjonctival ou cornéen est considéré comme le gold standard du diagnostic d'une infection active. L'inconvénient de cette technique est le retard inévitable dans l'attente des résultats de la culture virale. Cet inconvénient, associé au fait que le test PCR est plus sensible que ce test ou que la recherche d'anticorps fluorescent, justifie que la PCR est probablement aujourd'hui le test diagnostique le plus couramment pratiqué pour le FHV-1.
IV- Traitement et prevention
Le traitement de la maladie oculaire due au FHV-1 est difficile. Les médicaments antiviraux peuvent être coûteux et nécessitent une bonne observance de la part du propriétaire et du patient. Les réponses cliniques des patients peuvent être variables. Le choix de l'approche thérapeutique appropriée nécessite un bon jugement clinique, avec l'évaluation de facteurs tels que la gravité et le stade de la maladie clinique, l'observance du patient et du propriétaire, et les considérations financières.
Deux enjeux existent dans le traitement de ces kératites herpétiques : le traitement de la phase aiguë et la gestion du risque de récidive.
Il n’existe à ce jour aucune formulation vétérinaire antivirale. Les molécules antivirales disponibles proviennent de la pharmacie humaine. De nombreuses études relatent de l’utilisation de produits antiviraux topiques ou systémiques humains sur les conjonctivites herpétiques du chat et révèlent des différences de biodisponibilité et de toxicité nette entre les deux espèces qui contre-indiquent toute extrapolation thérapeutique entre ces deux espèces. Les antiviraux sont des virostatiques qui ne s’utilisent que pendant la phase active de conjonctivite ; ils n’ont aucune utilité dans la prévention d’une rechute lors de phase de latence. La durée classique du traitement est généralement d’une semaine après la résolution des signes cliniques, soit 3 à 4 semaines de traitement.
Différentes formulations ont montré leur efficacité chez le chat :
- Les traitements antiviraux topiques.
- La trifluridine (Virophta®) très efficace avec une bonne pénétration cornéenne mais potentiellement irritante.
- Le ganciclovir (Virgan®) a montré son efficacité et sa bonne tolérance locale.
L’avantage du traitement topique est la bonne tolérance des produits et l’absence de toxicité pour le chat. L’inconvénient majeur est lié au caractère virostatique des produits qui nécessitent une application fréquente > 5 fois par jour.
- .Les traitements systémiques
- L’aciclovir est bien décrit en médecine humaine, mais sa faible biodisponibilité et sa toxicité limitent son utilisation chez le chat.
- Le valaciclovir ne doit pas être utilisé chez le chat en raison de sa forte toxicité rénale et hépatique.
- Le penciclovir (et sa pro-drogue le famciclovir) est la molécule de choix pour un traitement systémique antiherpétique. De nombreuses études tentent de déterminer la dose efficace et les recommandations varient de 62,5 mg/chat à 90 mg/kg TID. Récemment une étude menée sur des chats présentant des formes oculaires, cutanées et respiratoires spontanées d’herpesvirose, présente une résolution des signes cliniques et une durée moyenne de traitement plus rapide à 90 mg/kg/j, comparée à une dose de 40 mg/kg/j. (Thomasy SM, 2016) La même équipe a par ailleurs montré dans une autre étude expérimentale que la dose de 90 mg/kg BID permettait d’atteindre une concentration dans les larmes supérieure, à la dose de 40 mg/kg TID et équivalente, à la dose de 90 mg/kg TID chez des chats sains. (Sebbag L, 2016) La dose recommandée serait donc 90 mg/kg matin et soir, bien qu’une marge de manœuvre puisse exister.
Le traitement antiviral doit être couplé à un traitement hygiénique local. Un traitement antibiotique est recommandé pour la gestion des surinfections bactériennes (notamment Chlamydophila spp et Mycoplasma spp) fréquentes dans un contexte herpétique, et en cas d’ulcère en antibioprévention. Le rôle de la lysine dans la prévention de la réactivation virale et dans le traitement d’une herpesvirose, reste très controversé. Les études montrent son innocuité, mais il n’existe pas de consensus quant à son efficacité. Les interférons alfa ou oméga permettraient de réduire la réplication virale et auraient une action synergique avec l’aciclovir. Cependant, les résultats restent à ce jour, contradictoires quant à leur efficacité.
Ces traitements médicamenteux doivent être associés à une prise en charge comportementale, visant à minimiser le stress, de façon à réduire le risque de récidives en particulier lorsque celles-ci sont fréquentes, sévères ou chroniques.
> Uvéite : diagnostic et recherche étiologique
Chenove France
I- Introduction
L’uvéite féline est souvent une maladie insidieuse, douloureuse, de présentation clinique subtile et qui peut mettre en danger la vision et parfois la vie du chat.
II- Définition/ Classification
L’uvéite est, par définition, une atteinte inflammatoire de l’un ou plusieurs des composants de l’uvée à savoir l’iris, le corps ciliaire et la choroïde, qui se situent entre la tunique fibreuse extérieure du globe (cornéosclérale) et la tunique interne neurosensorielle (la rétine). En fonction de la localisation de l’inflammation, on définit que l’uvéite est antérieure si elle intéresse l’iris, intermédiaire si elle intéresse le corps ciliaire seul, postérieure si elle intéresse la choroïde et on parle de panuvéite si tous les secteurs sont concernés. L’iris et le corps ciliaire étant étroitement liés, on peut rencontrer des iridocyclites regroupées sous le terme d’uvéite antérieure. De même, la choroïde et la rétine sont tellement proches anatomiquement et fonctionnellement que les uvéites postérieures sont assez inévitablement des choriorétinites.
III- Etiologie, conséquences thérapeutiques
Chez l’Homme, les carnivores domestiques et en particulier le jeune chat, les causes d’uvéite sont très nombreuses et variées. Leur identification est un défi dans toutes les espèces, voire un casse-tête ! On parle pudiquement d’uvéite idiopathique quand la cause n’est pas mise en lumière, jusqu’à 70% des cas en fonction des études et des circonstances [1].
Il faut tout d’abord distinguer les causes systémiques (endogènes) des causes non systémiques (exogènes). Ces dernières incluent les traumatismes, les kératites ulcératives sévères et, exceptionnellement chez les jeunes chats, les luxations du cristallin et cataractes : elles sont facilement reconnaissables à l’examen ophtalmologique. Les causes systémiques, par contre, sont complexes et doivent elles-mêmes, être subdivisées en 2 catégories opposées : celles pour lesquelles un agent causal est identifié et celle sans agent causal avéré. Si l’agent pathogène est identifié, il doit être spécifiquement traité par voie générale et l’inflammation est gérée localement, sans recourir à un traitement immunosuppresseur par voie générale. A l’inverse, s’il n’y a pas d’antigène identifié, donc de traitement médical spécifique, des mécanismes dyssimmunitaires (auto-immunitaires) sont suspectés comme responsables de l’inflammation chronique : on privilégie alors une thérapie immunomodulatrice systémique agressive non spécifique, en prévenant des risques de récidives..
Le virus de la péritonite infectieuse féline (PIF) peut être responsable d’une uvéite antérieure, avec ou sans signes généraux. L’uvéite est plus souvent antérieure, de type granuleux, avec une inflammation irienne (changement de couleur des iris), des exsudats fibrineux en chambre antérieure, qui peuvent précipiter sous forme de dépôts endothéliaux. Le segment postérieur peut aussi être le siège d’inflammation sous la forme de dépôts vitréens, de manchons périvasculaires autour des vaisseaux rétiniens, de décollements de rétine et de névrite optique.
Le virus de l’immunodéficience féline (FIV) est une cause majeure d’uvéite antérieure/ intermédiaire. Il est associé à une uvéite antérieure d'intensité modérée, chronique, avec des floculats en chambre antérieure et des précipités endothéliaux peu nombreux. L’inflammation cellulaire du vitré antérieur est courante, alors que les atteintes rétiniennes et choroïdiennes sont rares.
Le virus leucémogène félin (FeLV) existe chez le (très) jeune chat : il peut, à cet âge, provoquer une uvéite à la fois antérieure (afflux cellulaire en chambre antérieure donnant un effet Tyndall, inflammation irienne sous forme de nodules iriens et dépôts endothéliaux de grande taille) et postérieure (hémorragies et décollement rétiniens, plages de choriorétinite et névrites optiques).
Le rôle de Toxoplasma gondii est sujet à discussions. Il est, à coup sûr, responsable de certaines uvéites, notamment postérieures (choriorétinites), lors d’exposition primaire avec d'atteinte systémique. En revanche, lors d’uvéites chroniques, sur les chats plus âgés et en bonne santé, il est difficile d’établir si le parasite est vraiment responsable de l’inflammation oculaire, puisque de nombreux chats sains sont séropositifs. [3]
De façon exceptionnelle, on décrit des uvéites félines d’origines protozoale (quelques cas de leishmaniose félines dans des zones très endémiques), parasitaire ou fongique. En revanche, des cas (de moins en moins rares) d’uvéite à Encephalitozoon cuniculi ont été rapportés chez le chat, avec des formes ressemblant à celles rencontrées classiquement chez le lapin : uvéite antérieure avec atteinte capsulaire antérieure et cataractes focales. [4]
IV- Diagnostic des uveites chez le jeune chat
1. Contexte épidémiologique
Étant donné la diversité des causes d’uvéite, dans toutes les espèces et notamment chez le chat, l’étude du contexte épidémiologique est un prérequis indispensable à la démarche diagnostique raisonnée, en plus de l’examen général complet. En second lieu, le recueil de l’anamnèse permet d’orienter ou non vers des causes traumatiques (AVP, chutes, bagarres…) et une attention particulière est portée à la durée et la récurrence des symptômes, les uvéites exogènes ayant tendance à être aiguës et à rétrocéder alors que les uvéites endogènes, plus chroniques.
2. Signes cliniques (Voir figure 2)
L’examen ophtalmologique doit être minutieux et systématique, sur les 2 yeux, les atteintes pouvant être uni- ou bilatérales, symétriques ou assymétriques.
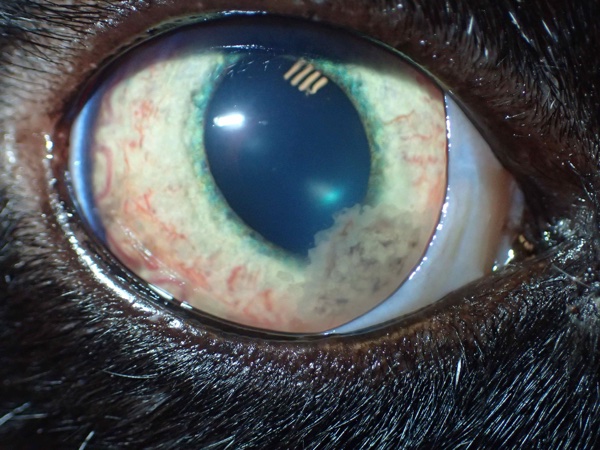
Figure 2
Les signes d’uvéite sont des combinaisons des signes classiques d’inflammation au sens large (chaleur, douleur, gonflement, rougeur, et perte de fonctionnalité) non spécifiques, comme :
- la douleur oculaire, qui se manifeste par un blépharospasme, plus ou moins systématique/ intermittent,
- l’hyperhémie conjonctivale, bulbaire, sous la forme de rougeur diffuse entre les vaisseaux conjonctivaux,
- l‘exsudation en chambre antérieure, soit sous la forme de exsudats en chambre antérieure, hypopions ou coagulâts plus ou moins hémorragiques, soit sous la forme de précipités endothéliaux, qui sédimentent en partie déclive et se déposent contre l’endothélium cornéen en tâches jaunâtres voire pigmentées, soit sous forme de cellules et protéines en suspension dans l’humeur aqueuse provoquant l’effet dit « Tyndall » bien visible en fente lumineuse au stade initial,
- l’iritis (inflammation irienne), pathognomonique, qui se manifeste par la congestion des vaisseaux iriens, visible à sa surface par une rougeur anormale des vaisseaux eux-mêmes ou par un changement de couleur générale de la surface (passant du bleu au violet ou du jaune au marron ou du vert à l’orangé), ou encore par la présence de nodules inflammatoires multifocaux,
- le myosis, non systématique mais facilement repérable par comparaison avec la taille de l’autre pupille si l’uvéite est unilatérale, lors d’uvéite antérieure,
- la diminution de pression intra-oculaire, qui n’est pas systématique non plus, mais signant une atteinte du corps ciliaire, mesurable à l’aide d’un tonomètre,
- la diffusion cellulaire lors de parsplanite, souvent homogène le long de la hyaloïde antérieure, ou intra-vitréenne, sous forme de floculats plus hétérogènes,
- les différentes expressions de choriorétinite, comme les hémorragies et les manchons périvasculaires rétiniens visibles en ophtalmoscopie, les décollements de rétine, les papillites (difficiles à caractériser chez le chat)…
- l’œdème cornéen est souvent difficile à observer, bien plus discret que chez le chien.
Lors de l’examen ophtalmologique, on recherchera concomitamment des signes spécifiques de causes exogènes : ulcères cornéens, perforations cornéennes ou sclérales, cataractes traumatiques, corps étrangers, …
3. Examens Complémentaires (Tabieau 1)
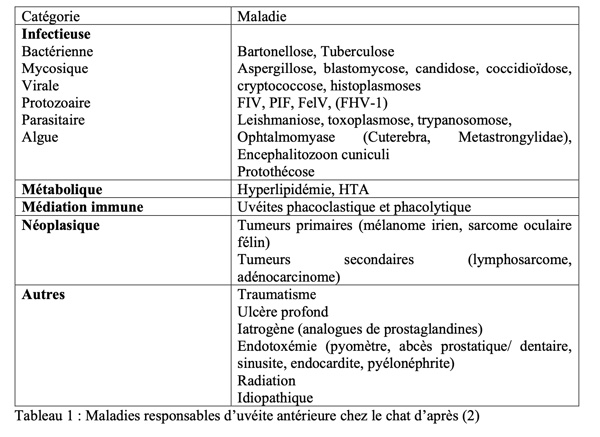
Tableau 1
De manière générale, les analyses sanguines doivent inclure un bilan biochimique minimal, accompagné d’une électrophorèse de protéines sériques en cas d’hyperglobulinémie. La numération-formule est primordiale, explorant la présence d’inflammation, d’anémie, de thrombopénie… L’analyse d’urine est importante, révélant notamment une protéinurie évocatrice de maladies systémiques ou infectieuses. Le recours à des examens d’imagerie (radiographies, échographies), est indiqué pour rechercher des lésions pulmonaires ou cavitaires.
De manière plus spécifique, on déploie aussi des examens complémentaires ciblés dans la recherche d’agents infectieux chez le jeune chat, lors d’uvéite :
a) Mise en évidence de l’agent infectieux dans le tissu/ fluides oculaires
La PCR sur humeur aqueuse constitue à l’heure actuelle la base de la recherche étiologique des uvéites infectieuses notamment isolées, chez le jeune chat. Les résultats de la PCR sont à analyser avec finesse : la sensibilité dans la recherche du virus de la PIF par exemple est médiocre et dans une autre mesure, la présence d’un microorganisme non responsable de l’uvéite sur la surface oculaire ou dans du sang contaminant, ou même dans l’humeur aqueuse à cause de la rupture de la barrière hématoaqueuse, peut constituer un faux positif. La PCR est, en revanche, très spécifique.
b) Mise en évidence sérologique des témoins de l'infection
L’intérêt des recherches sérologiques est discuté et dépend de l’agent infectieux recherché. La présence d’anticorps circulants ne révèle qu’une exposition passée à l’agent infectieux : par exemple, un titre d’IgG à Toxoplasma gondii peut rester élevé pendant des années sur un animal en parfaite santé. Enfin, dans le cas particulier de la PIF, la sérologie ne permet pas de différencier les anticorps spécifiques de la PIF de ceux de la forme entéritique.
c) Mise en évidence d’anticorps spécifiques intraoculaires
Il est possible, en outre, de détecter la présence d’anticorps spécifiques produits par les lymphocytes dans l’humeur aqueuse, ce qui permet, théoriquement, le diagnostic étiologique de l’uvéite (cf coefficient de Goldmann-Witmer).
V- Conclusion
Les uvéites félines sont assez facilement repérables cliniquement, par des signes cliniques non spécifiques, accessibles lors d’examen ophtalmologique bien conduit. Ce dernier doit automatiquement s’accompagner d’un examen général attentif, tant les étiologies sous-jacentes peuvent être graves, comme une PIF chez un jeune chat dont le pronostic vital sera, par conséquent, engagé. Le recours aux examens complémentaires sera discuté avec les propriétaires en fonction de la forme de l’affection et des autres données disponibles.
Bibliographie
- Davidson MG, Nasisse MP, English RV, Wilcock BP, Jamieson VE. Feline anterior uveitis: A study of 53 cases. J Am Anim Hosp Assoc 1991; 22: 77–83.
- Townsend WM. Canine and feline uveitis. Vet Clin North Am Small Anim Pract. mars 2008;38(2):323-46, vii.
- Maggs D. Feline uveitis: an intraocular lymphadenopathy. J Of Feline Med and Surg 2009; 11, 176-182.
- Benz P, Maass G, Csokai J, Fuchs-Baumgartinger A, Schwendenwein I, Tichy A, et al. Detection of Encephalitozoon cuniculi in the feline cataractous lens. Vet Ophthalmol. Sept 2011;14 Suppl 1:37-47.
