> La vision de l'imageur
Lyon France
I- Introduction
La péritonite infectieuse féline (PIF) résulte d’une infection virale par un coronovarirus digestif ayant subi une mutation au sein de l’animal. De multiples présentations cliniques ont été décrites, rendant le diagnostic de cette affection particulièrement difficile. Cette maladie étant multi-organique, différentes techniques d’imagerie médicale devront être utilisées pour aider à son diagnostic.
On distingue classiquement deux formes de PIF, dites « humide » et « sèche ». La première se caractérise par une vascularite immuno-médiée à l’origine d’une accumulation liquidienne riche en protéines au sein des espaces péritonéal, pleural, péricardique ou sous-capsulaire rénal. La seconde est caractérisée par une inflammation granulomateuse ou pyogranulomateuse d’organes multiples, en particulier les reins, le foie, les yeux et l’encéphale. C’est cette dernière forme qui va présentement nous intéresser, beaucoup plus difficile à diagnostiquer que la première.
II- Lésions abdominales
1. L’espace péritonéal
La radiographie abdominale est souvent l’examen de première intention pour évaluer les organes abdominaux. Pourtant son intérêt est limité dans le diagnostic de la PIF. La radiographie peut cependant révéler la présence d’une masse abdominale ou d’une diminution du contraste, signes d’appel pour une exploration plus poussée.
Le contraste radiographique est lié à la présence de graisse entre les différents organes, dont l’opacité, plus faible que celle des organes parenchymateux permet de souligner leurs contours. En cas de péritonite, la présence d’un épanchement et d’une inflammation des graisses (panniculite) conduit à une augmentation diffuse de l’opacité abdominale et à une perte des contours des différents organes. Sur les formes sèches de PIF, une diminution du contraste peut être liée à une inflammation des graisses et à la présence d’un discret épanchement réactionnel aux lésions granulomateuses.
La présence d’une masse abdominale se manifeste à la radiographie par la visualisation d’une structure d’opacité liquidienne, en position souvent centrale, créant un effet de masse sur le reste des organes abdominaux, en particulier les anses intestinales. Ces masses sont le plus souvent lymphatiques, parfois digestives.
Seule l’échographie permettra de déterminer précisément leur origine, et de réaliser des cytoponctions ou biopsies échoguidées. L’échographie abdominale est donc l’examen de choix pour explorer des lésions abdominales suspectes de PIF.
2. Les organes parenchymateux
La PIF est une maladie dite « pyogranulomateuse », caractérisée par sa grande variabilité de type lésionnel et d’organes cibles.
Les organes les plus souvent affectés par une infiltration pyogranulomateuse ou granulomateuse lors de PIF sont les reins et le foie. L’infiltration peut être diffuse ou focale, nodulaire ou infiltrative.
Dans une étude échographique réalisée sur 16 chats atteints de PIF, le foie était de taille normale dans 81% des cas. Ainsi à la radiographie, aucune anomalie hépatique n’est le plus souvent visible. Environ deux tiers des chats présentaient un foie d’échogénicité normale. Pour le tiers restant, certains présentaient un foie diffusément hypoéchogène et d’autres présentaient des lésions focales hyper ou hypoéchogènes.
A la différence du foie qui est le plus souvent de taille normale, les reins sont, quant à eux, souvent de taille augmentée lors de PIF (environ la moitié des cas). Peu d’affections rénales sont à l’origine d’une néphromégalie, cette trouvaille doit donc être considérée avec attention. Cette néphromégalie peut éventuellement être détectée à la radiographie.
L’échogénicité du parenchyme rénal est variable en cas de PIF, traduisant la grande variété de lésions possibles. Le cortex peut être hyperéchogène, hypoéchogène ou d’échogénicité normale. On retiendra cependant qu’une hyperéchogénicité corticale diffuse à l’origine d’une augmentation de la distinction cortico-médullaire est particulièrement rapportée dans la littérature. L’échogénicité de la médulla est également variable, cependant un aspect strié radiaire hyperéchogène est également fréquent.
Enfin, un tiers de cas de l’étude échographique sur 16 chats présentaient un halo hypoéchogène sous-capsulaire. Ce dernier est secondaire à une infiltration cellulaire de l’espace sous-capsulaire. Bien que non spécifique de la PIF, il n’a été rapporté en dehors de cette dernière que dans des cas d’infiltration tumorale (lymphome en particulier).
Bien que les lésions rénales soient fréquentes à l’échographie en cas de PIF, des reins normaux n’excluent pas une infiltration granulomateuse. En effet 2 des 9 chat qui présentaient des lésions de PIF à l’examen histologique n’avaient pas de lésion visible à l’échographie.
Les nœuds lymphatiques abdominaux sont également souvent le siège d’une infiltration inflammatoire, à l’origine d’une adénomégalie et d’un aspect hypoéchogène, parfois hétérogène, à l’échographie (9/16).
3. Le tube digestif
Le tube digestif n’était remanié échographiquement que dans 19% des cas. Les lésions associées sont assez variables, le plus souvent diffuses dans cette étude, caractérisées par un épaississement de la paroi des anses intestinales et moins fréquemment du colon. L’échostructure en couches est généralement conservée pour l'intestin grêle, mais des cas d’atténuation, voire de disparition des couches échographiques sont rapportés, en particulier pour les lésions coliques (Figure 1).
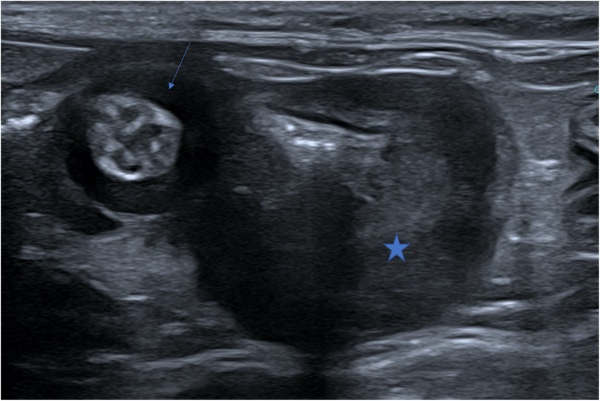
Figure 1. Échographie de la jonction iléo-colique chez un chat atteint de PIF, montrant un épaississement circonférentiel de la musculeuse iléale (flèche) et un épaississement asymétrique de la paroi colique dont l’échostructure en couches n’est plus visible.
Des masses digestives uniques ont également été rapportées sur des cas de PIF confirmés à l’examen histologique, représentant jusqu’à 17% des cas.
III- Lésions thoraciques
A l’instar des lésions abdominales, les lésions observées dans la cavité thoracique en cas de PIF sont variables et pas toujours visibles.
La radiographie est l’examen de choix et de première intention pour évaluer le thorax, souvent motivée par la présence d’une dyspnée et potentiellement d’une discordance.
Cette dernière, en cas de PIF, est souvent secondaire à la présence d’un épanchement pleural (PIF humide), se manifestant par des bandes d’opacité liquidienne entre (scissures interlobaires) et autour des lobes pulmonaires.
Des lésions pulmonaires secondaires à une infiltration granulomateuse sont possibles dans les cas de PIF sèche et humide. Leur aspect est variable, le plus souvent multifocal, avec de multiples plages et nodules plus ou moins bien délimités d’opacité augmentée. Ces lésions sont souvent plus faciles à détecter au scanner, qui permet de s’affranchir des superpositions inhérentes à la radiographie. Ceci est particulièrement intéressant lors d’épanchement pleural associé aux lésions pulmonaires, alors masquées à la radiographie par la superposition et l’atélectasie des lobes.
IV- Lésions du système nerveux central
La PIF est la maladie infectieuse du système nerveux central la plus fréquente chez le chat. Environ 38% des cas de formes humides et 5% des cas de formes sèches, sont présentées avec une atteinte du système nerveux central, à l’origine de troubles neurologiques divers en fonction de la neurolocalisation des lésions (ataxie, latérocolis, crises convulsives, myélopathie).
La PIF induit des lésions de vascularite pyogranulomateuse en regard des leptoméninges, de l’épendyme et des plexus choroïdes (sites de production du liquide céphalo-rachidien LCR).
L’examen du système nerveux central nécessite des techniques d’imagerie en coupe. Idéalement un examen par résonnance magnétique (IRM) devra être réalisé. Bien que de plus en plus disponible, cette technique d’imagerie n’est pas toujours envisageable et un examen scanner lui est parfois préféré par défaut.
L’examen IRM est un examen sensible pour détecter les lésions de PIF. Dans une étude réalisée sur 24 chats présentant une forme neurologique de PIF, confirmée à l’examen histologique, tous les animaux présentaient des lésions de l’encéphale.
Les lésions les plus fréquemment rencontrées étaient une dilatation des ventricules latéraux, et un réhaussement des méninges et de l’épendyme. L’épendyme est une membrane qui tapisse les ventricules latéraux et le canal central de la moelle spinale.
Par ailleurs un effet de masse est souvent noté, secondairement à la dilatation du système ventriculaire, à l’origine d’une hernie du vermis cérébelleux au travers du foramen magnum.
Bien que moins précis que l’IRM du fait de sa moins bonne résolution en contraste, le scanner permet parfois de mettre en évidence ces mêmes lésions très évocatrices de PIF (Figure 2).
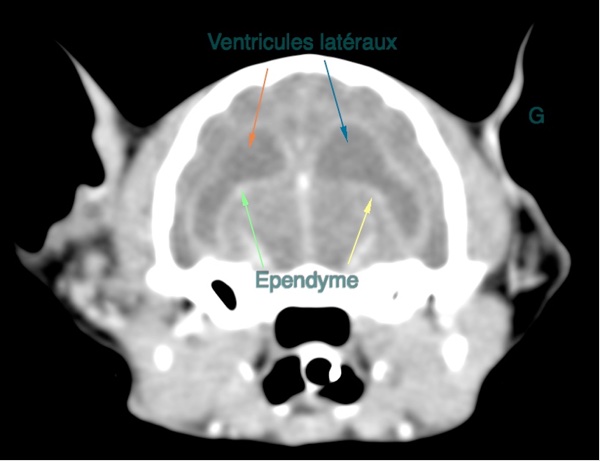
Figure 2. Reconstruction transversale au scanner de l’encéphale d’un chat atteint de PIF, montrant une dilatation des ventricules latéraux et un épaississement ainsi qu’une prise de contraste augmentée de l’épendyme.
V- Lésions autres
Un site préférentiel d’atteinte de PIF est l’œil. La PIF est en effet à l’origine d’uvéites graves, qui peuvent atteindre tout ou partie de la tunique vasculaire de l’œil (uvée), c’est à dire l’iris, les corps ciliaires ou la rétine. Si toute l’uvée est atteinte on parle de panuvéite. Le diagnostic est généralement clinique, mais les lésions peuvent être explorées à l’échographie. Elles apparaissent comme un épaississement de la partie atteinte de l’œil. La PIF est parfois responsable d’une masse intra-oculaire granulomateuse et l’échographie peut aider à déterminer sa localisation anatomique plus précisément.
Enfin, bien que rarement rencontrée du fait du statut castré de la plupart des chats mâles, une orchite est également un signe évocateur de PIF. Dans l’étude échographique, sur 16 chats atteints de PIF, l’un d’entre eux était entier et présentait une orchite granulomateuse visible à l’échographie par une augmentation de taille des deux testicules, associée des plages hyperéchogènes et une disparition complète de l’échostructure testiculaire classiquement observée. Ce type d’orchite pyogranulomateuse avait déjà été rapporté auparavant chez un chat atteint de PIF.
VI- Conclusion
A l’image de sa très grande variabilité d’expression clinique, les lésions attendues en imagerie médicale sur un animal atteint de PIF sont diverses. C’est l’examen clinique qui doit dicter quelle partie de l’animal doit être imagée, et en fonction, la technique d’imagerie la plus adaptée sera choisie. Bien que l’imagerie médicale ne permette pas un diagnostic de certitude, les lésions observées sont parfois très évocatrices dans un contexte épidémiologique souvent classique. Par ailleurs l’échographie est l’outil idéal pour réaliser les prélèvements nécessaires à la réalisation d’analyses plus poussées, biologiques ou histologiques, qui permettront quant à elles un diagnostic de certitude de PIF.
> La péritonite infectieuse féline, forme sèche : la vision de l'ophtalmologue
Chenove France
I- Introduction
Le coronavirus entérique félin est inoffensif, et très fréquemment rencontré chez le chat. Il peut subir de manière sporadique des mutations spontanées et être responsable de la péritonite infectieuse féline (PIF). Environ 5 % des chats infectés par le coronavirus développent une PIF (jusqu’à 12 % dans les communautés félines) parmi lesquels la forme humide est la plus fréquente (80% des cas). Dans les autres cas, la forme sans épanchement, dite « sèche » se caractérise par le développement de granulomes et évolue, avec des signes cliniques plus insidieux, alors en lien avec les organes atteints (troubles neurologiques, signes oculaires, dysfonctionnement organique, ...). Le travail des vétérinaires et particulièrement des ophtalmologues et des neurologues dans ces cas, est de détecter les signes évocateurs de ces formes moins fréquentes et d’alerter des propriétaires de ces jeunes chats, dont le pronostic vital est très engagé. La PIF représente la cause de décés d’origine infectieuse la plus fréquente chez le chat (0,3 à 1,4 % des décès chez le chat) mais certaines formes très transitoires ne sont pas fatales.
II- Signes cliniques des uvéites associés à la PIF
1. Contexte épidémiologique
Bien que l’ophtalmologie soit une discipline d’observation, avec de nombreux cas des signes cliniques pathognomoniques, le cas des uvéites et en particulier de la PIF nécessite une approche particulièrement soignée du contexte épidémiologique. Ce dernier apporte des informations précieuses alors que les signes cliniques peuvent être frustes et le diagnostic de certitude de péritonite infectieuse féline toujours difficile. Les chats atteints d’uvéite à coronavirus sont souvent des jeunes chats : la médiane est de 1,4 ans pour ce profil alors que, pour comparer, l’âge médian des chats atteints d’uvéite sur lymphome est de 12 ans, et de 7,8 ans toutes causes d’uvéites confondues. Dans la pratique, il ne faut pas négliger quand même le profil d’une autre typologie de chats plus âgés (au-delà de 10ans) qui, pour des raisons moins évidentes, peuvent développer une uvéite à PIF avec un pronostic vital tout aussi engagé. Le coronavirus pathogène pèse lourd dans le diagnostic différentiel difficile des uvéites et doit toujours être envisagé: dans une étude anglaise récente [1], 16 % des chats présentés avec une uvéite ont été finalement diagnostiqués avec une PIF. Dans cette étude, la PIF était la deuxiéme cause la plus fréquente d’uvéite après les formes idiopathiques et donc la première cause infectieuse, ce qu’il faut bien garder à l’esprit. En revanche, les ophtalmologues sont surtout sollicités dans les formes sèches : les signes neurologiques et l’uvéite sont présents chez 60% des chats atteints de PIF sans épanchement, et chez seulement 9% des chats atteints de formes humides. Si l’on regroupe toutes les formes de PIF, environ 30% des chats ont manifestations oculaires.
Enfin, certaines races (Abyssin, Birman, Bengal, Ragdoll...) semblent plus prédisposées que d’autres (Persan, Siamois, Bleu russe...) tout comme certaines lignées qui sont sur-représentées parmi les chats atteints.
2. Examen ophtalmologique
Elément clé du diagnostic, l’examen ophtalmologique est évidemment fondamental mais il doit faire suite à un examen général soigné (profil de croissance chez les jeunes, état d’embonpoint, température, état d’hydratation, aspect des muqueuses, présence d’épanchements, de signes neurologiques…). L’uvéite à PIF est plus souvent antérieure, elle n’est pas systématiquement bilatérale ou symétrique et elle est accompagnée, ou non, de signes généraux. L’inflammation est de type (pyo-)granulomateuse.
Classiquement, on observe des précipités endothéliaux, appelés aussi dépôts rétrokératiques, observés en cadran inférieur, d’aspect jaune terne à brun, dits « en graisse de mouton ». Il s’agit de protéines et cellules inflammatoires, libérées en chambre antérieure depuis l’uvée inflammée, et qui précipitent en région déclive derrière la cornée. Ils sont associés, ou non, à un exsudat typique, fibrineux, prenant la forme d’un nuage coagulé dans l’aire pupillaire. L’iris est hyperhémié de façon parfois diffuse et sa couleur change, devient plus terne ou plus brunâtre, facile à repérer par comparaison avec l’œil adelphe quand l’atteinte est unilatérale : les iris verts deviennent bruns, les bleus deviennent violets. L’association d’exsudats en chambre antérieure et d’iritis, même discrets, doivent absolument attirer l’œil du praticien et déclencher une prise en charge dans la mesure où ce sont souvent les premiers symptômes de la forme sèche de PIF, dont on connait malheureusement le pronostic… Le myosis n'est pas systématique, l’hypotension et le blépharospasme non plus, mais ils sont très évocateurs d’une uvéite (non spécifique) (Figure 1). En revanche, des dépôts protéiques ou cellulaires peuvent être présents sur les capsules cristalliniennes (antérieure ou postérieure) et sur la hyaloïde antérieure (membrane antérieure du vitré), donnant un aspect sale au vitré antérieur et pouvant gêner l’examen ophtalmoscopique du segment postérieur.
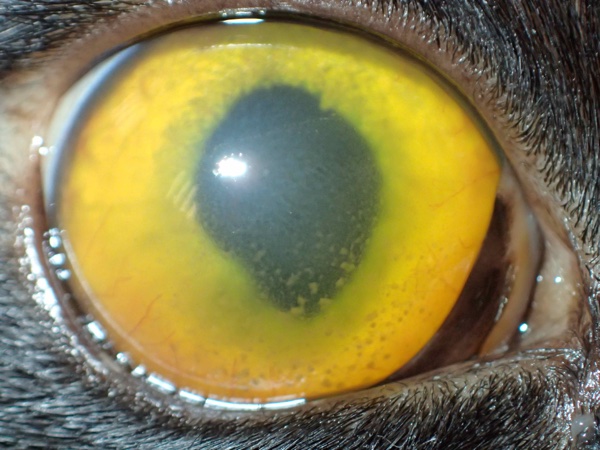
Figure 1
L’atteinte du segment postérieur est moins fréquente; elle se manifeste sous la forme de manchons inflammatoires périvasculaires, autour des vaisseaux rétiniens, mais aussi sous la forme de décollements de rétine localisés et parfois sous la forme de névrite optique. C’est par ophtalmoscopie (indirecte/ directe) que ces lésions sont identifiées. L’atteinte inflammatoire papillaire n’est pas facile à caractériser chez le chat, à moins de décollement de rétine périphérique.
III- Diagnostic de la PIF seche : Intérêt de la ponction d’humeur aqueuse
La complexité du diagnostic de péritonite infectieuse féline n’est plus à démontrer et ce diagnostic s’inscrit obligatoirement dans une démarche de médecine interne (cf présentations spécifiques à ce sujet). Il n’en demeure pas moins que, dans les cas de forme sèche où l’uvéite est le seul symptôme présent, l’œil est une porte d’entrée intéressante pour avancer dans la démarche diagnostique et notamment par le recueil d’humeur aqueuse (paracentèse) comme liquide d’analyse.
1. Analyse du liquide de paracentèse
L’humeur aqueuse (HA) recueillie lors de PIF contient un mixte de cellules inflammatoires et notamment des macrophages porteurs du virus. Malheureusement, la cytologie et l’immunocytochimie sont souvent non diagnostiques de la PIF sur l’HA car trop peu spécifiques (alors que l’immunocytochimie est contributive sur cellules du LCR dans cette même PIF [2]). En revanche, la cytologie sur HA permet le diagnostic cellulaire des lymphomes, en cas d’uvéite dont la présentation clinique est commune à la PIF.
De manière générale dans la PIF, il est intéressant d’utiliser la PCR sur des prélèvements d’organe, de l’épanchement, du LCR ou de l’humeur aqueuse, puisque le coronavirus n’est pas censé être retrouvé dans ceux-ci. Pour tous ces prélèvements, la spécificité est excellente, proche de 100 % ce qui veut dire, en pratique, qu’un résultat PCR positif est quasiment la « preuve » d’une PIF (même si le vrai seul diagnostic de certitude est l’immunohistochimie). En revanche, la sensibilité est meilleure (moins de faux négatifs) dans les ponctions d’organes ou de nœuds lymphatiques mésentériques (90 %), les épanchements (85 %), le LCR (86 %) que dans l’humeur aqueuse (40 %). En pratique, cela veut dire qu’une PIF réellement présente n’est détectée dans l’HA que dans 40% des cas lors de ce test : un résultat positif est donc quasiment diagnostic de PIF alors qu’un résultat négatif ne permet pas de l’exclure. Cette faible sensibilité s’explique en partie par le fait que le virus recherché se trouve dans les macrophages et que leur quantité dans l’HA varie. L’autre conséquence clinique est qu’en présence d’épanchements, d’adénopathie mésentérique ponctionnable ou de signes neurologiques, il est plus pertinent/sensible de faire la recherche PCR sur ces prélèvements que sur l’HA. Si les seuls symptômes sont uvéitiques, la paracentèse est l’examen de choix.
L’interprétation de la PCR pour le Coronavirus félin doit aussi tenir compte de données physiologiques. Certains laboratoires proposent des tests distinctifs FECV (virus entéritique moins virulent, non pathogène) versus biotype FIPV (virulent et pathogène). En absence de distinction proposée entre les souches, la charge virale est une indication, notamment si elle est très élevée dans l’humeur aqueuse et dans un contexte clinique évocateur. En théorie, le virus non muté ne peut pas se retrouver ailleurs que dans le tube digestif du chat. La détection PCR de Coronavirus dans l’humeur aqueuse signerait alors un diagnostic de certitude de PIF. Cependant, il semble que certains chats adultes asymptomatiques hébergent le virus muté. Enfin, il est possible lors d’uvéite isolée, juste après une primo-infection digestive chez le chaton, de pouvoir trouver ces Coronavirus dans l’humeur aqueuse concomitamment à une virémie transitoire (et une excrétion rectale importante). Certains de ces chatons ne récidivent pas leur uvéite après un traitement classique (d’uvéite), ne déclarent jamais de PIF maladie, notamment si la charge virale dans l’humeur aqueuse testée est faible ; cela tendrait à faire penser que leur système immunitaire maitrise ensuite la maladie ou que le virus, lors de cette virémie très précoce, n’a pas muté/ pas eu le temps de muter. On parle de stade pré-PIF.
Enfin, au cours des dernières années, une RT-PCR détectant de manière spécifique la mutation dans le gène S Spike a été mise au point. Initialement considérée comme un test de choix avec une spécificité de 100 %, des études plus récentes ont montré des résultats plus controversés quant à son utilité. En effet, il a été montré que l’utilisation de cette mutation n’augmente pas la spécificité de la RT-PCR mais diminue la sensibilité du test. [3 et 4].
IV- Conclusion
La PIF est une maladie trop grave et trop fatale pour que toutes ces formes ne soient pas reconnues précocement. L’uvéite isolée dans la forme sèche est un défi diagnostique qui doit impliquer le vétérinaire généraliste et d’élevage. Un délicat accompagnement des propriétaires effondrés se déclenche dès que la suspicion est posée, notamment dans des contextes d’adoption de jeunes chats de race.
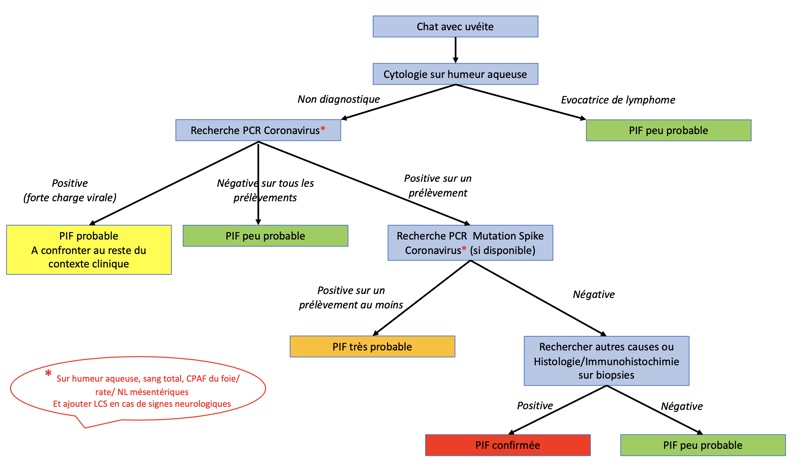
Figure 2
Bibliographie
- Wegg ML et coll. A multicenter retrospective study into endogenous causes of uveitis in cats in the United kingdom: ninety two cases. Vet Ophthalmol. 2021 ; 24 : 5
- Felten S, Matiasek K, Gruendl S, Sangl L, Hartmann K. Utility of an immunocytochemical assay using aqueous humor in the diagnosis of feline infectious peritonitis. Vet Ophthalmol. 2018;21(1):
- Sangl L, Felten S, Matiasek K, Dôrfelt S, Bergmann M, Balzer HJ, et al. Detection of feline coronavirus RNA, spike gene mutations, and feline coronavirus antigen in macrophages in aqueous humor of cats in the diagnosis of feline infectious peritonitis. J Vet Diagn Invest. juill 2020;32(4):5
- Felten S, Hartmann K. Diagnosis of feline infectious peritonitis: a review of the current literature. Viruses. 2019 ; 11 : 1010
> La péritonite infectieuse féline, forme sèche : la vision du neurologue
Paris
La mutation de la souche de coronavirus (FECV) en PIF entrainerait chez le chat une infection des macrophages à l’origine d’une réaction à médiation immune soit de forme effusive dite « humide » abdominale ou thoracique, soit de forme dite « sèche » et notamment cérébrale ou médullaire qui conduit à sa mort ; l’atteinte du système nerveux est retrouvée aussi dans la forme effusive avec ou sans signes cliniques. L’incidence de cette infection avoisine les 50% comme cause de maladie inflammatoire du système nerveux chez le chat, surtout s’il a moins de 4 ans, s’il est de race, ou de sexe mâle. L’incidence des myélites est aussi très haute chez les chats présentant une forme péritonéale.
Les signes cliniques focaux ou multifocaux reflètent la localisation neuroanatomique de la réaction inflammatoire. Altération de l’état de conscience, trouble comportementaux, déficits de nerfs crâniens et syndrome vestibulaire central, ataxie, tétraparesie et hyperesthésie sont des signes classiques. La prostration, la fièvre, l’anorexie, la perte de poids et les atteintes oculaires sont des signes systémiques associés.
Le diagnostic passe par la recherche de signes généraux (adénomégalie, déformation rénale et splénique, atteinte respiratoire) mais aussi oculaires et l’exclusion d’autres causes nerveuses (lymphome, toxoplasmose, FeLV, FIV, maladie de surcharge ou hypoplasie cérébelleuse). Le diagnostic est basé sur le signalement de l’animal, les signes cliniques, la présence d’une anémie normocytaire normochrome non-régénérative et d’une leucocytose neutrophilique, d’une diminution du ratio albumine/globuline avec augmentation des pics α2-, β- et γ-. La ponction rachidienne montre une protéinorachie souvent supérieure à 2 g/L et une pléocytose de plusieurs dizaines à centaine de neutrophiles ou lymphocytes.
La simple présence d’anticorps montre que l’animal a été exposé au coronavirus et ne permet pas un diagnostic de certitude; c’est l’ensemble du cas (signalement, historique, clinique et examens complémentaires) qui conduit au diagnostic. La détection d’IgG dans le liquide cérébrospinal aurait une sensibilité de 60% (peu de faux négatifs) et une spécificité de 90% (très peu de faux positif). La sensibilité serait de 75% quand le chat a des signes nerveux avérés. L'imagerie en coupe (scanner et IRM) permet d’éliminer d’autres causes nerveuses et renforce le diagnostic. Une ventriculo-mégalie et une prise de contraste périventriculaire sont assez caractéristiques. Le diagnostic de certitude ne peut se faire à l’autopsie que par la mise en évidence histopathologique d’une réaction pyo-granulomateuse autour des ventricules et des méninges et une artérite nécrosante neutrophilique.
La PIF a longtemps été considérée comme une affection fatale. Le but thérapeutique est de réduire et contrôler les signes entrainés par la réaction inflammatoire immunitaire en utilisant des corticosteroïdes. Récemment l’antiviral inhibiteur de la 3C-like-protease (GC376) s’est montré très efficace pour améliorer les signes cliniques mais pas à long terme. Le GS-441524, a démontré une efficacité plus grande à moyen et long terme et depuis , bien que non autorisé, de nombreux propriétaires ont traité leur animaux avec un succès remarquable sans que des publications scientifiques bien conduites ne soient publiées. Il semblerait cependant que les formes nerveuses soient plus prônes à récidiver. Dernièrement le Molnupiravir développé pour la forme humaine COVID-19 inactive le virus. Il est en cours de documentation pour publication comme molécule de première ligne et comme traitement pour les chats qui ont des signes persistant ou récidivant suite à un traitement au GS-441524 ou au GC376.
La vaccination n’est toujours pas recommandée puisqu’elle augmenterait la vitesse de développement de la maladie.
> La péritonite infectieuse féline, forme sèche : perspectives thérapeutiques
Paris France
I- Le GS-441524 (et sa forme active, le remdesivir)
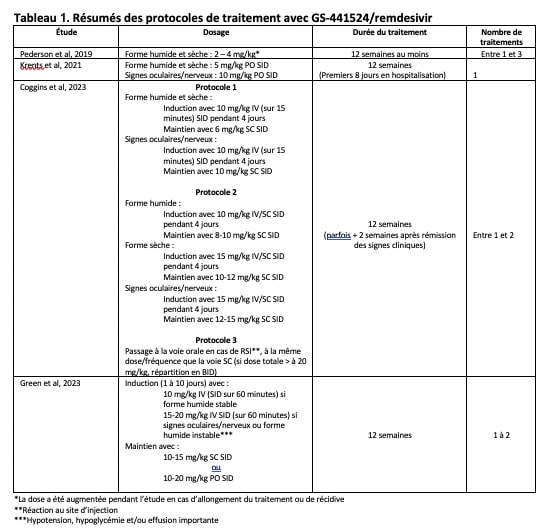
Le GS-441524 (et sa forme active, le remdesivir) agissent en inhibant l‘expression du RNA viral. Plusieurs études ont rapporté une bonne efficacité de ces molécules chez les chats ayant une coronavirose systémique, à la fois dans sa forme humide et dans celle sèche. Aujourd’hui, il est conseillé de réaliser un traitement d’une durée d’au moins 12 semaines, administrable par voie injectable (IV ou SC) et/ou par voie orale. Les doses recommandées à ce jour varient en fonction de la forme de la maladie (sèche versus humide ; avec/sans signes nerveux/oculaires) (tableau 1). L’analyse des études à notre disposition semblerait suggérer une phase d’induction par voie IV/SC pendant environ une semaine, suivi par une phase de maintien avec administration soit par voie SC, soit PO. Le passage à la voie orale étant fréquemment réalisé en raison de la gêne/lésions cutanées engendrées par l’administration SC. Des études « questionnaires » décrivent également des traitements réalisés entièrement par voie orale. Quant à la dose (entre 10 et 20 mg/kg SID), elle serait à choisir en fonction du tableau clinique (des doses plus élevées pour les atteintes oculaires et/ou nerveuses). Un ajustement des doses est à réaliser pendant toute la durée du traitement, en fonction du poids de l’animal. En général, environ 3 jours semblent nécessaires pour une amélioration clinique nette des chats atteints après mise en place du traitement antiviral, avec également résolution rapide (environ 10 à 15 jours) des effusions cavitaires. Néanmoins, des récidives sont rapportées pendant le traitement (nécessitant une augmentation des doses du médicament ou un changement de la voie d’administration) et/ou après le traitement (motivant un nouveau traitement antiviral). Lorsqu’une récidive est notée pendant/après le traitement, des augmentation de doses sont suggérées (environ + 5 mg/kg/jour). En cas de deuxième traitement, un nouveau protocole de 12 semaines est proposé par certains auteurs. A noter que si la voie orale est privilégiée, une administration à jeun est rapportée dans les études. Les effets secondaires connus à ce jour pour ces deux molécules incluent : des réactions en regard du site d’injection (en cas d’administration SC), des anomalies hématologiques, une augmentation des paramètres hépatiques (surtout des AlAT, qui serait à priori auto-résolutive), ainsi que la formation de calculs urinaires [1]. A noter qu’un syndrome d’hyperesthésie féline a été rapportés chez certains chats traités avec ces molécules. Toutefois, le lien avec ce syndrome et l’administration de ces antiviraux n’a pas été identifié et une possible séquelle de la maladie a également été avancée.
II- Le Molnupiravir
Le molnupiravir agit contre les virus à ARN en introduisant des erreurs de réplication de l'ARN. Dans le contexte de la "PIF", ce médicament a été décrit comme traitement initial de la maladie, ou comme traitement de deuxième intention en cas de manque de réponse/récidive suite à un (ou plusieurs) traitement(s) avec GS-441524/remdesivir. Dans une étude « questionnaire » portant sur 30 chats (diagnostic définitif de la PIF non renseigné), 4 d’entre eux avait été traités avec du molnupiravir en première intention, tandis que les 26 restant avait reçu cette molécule suite à un (16 chats), deux (7 chats) ou trois (3 chats) traitements avec du GS-441524/remdesivir. Parmi ces chats, 16 avaient des signes nerveux, 2 avaient des signes oculaires et 3 avaient des signes à la fois nerveux et oculaires. Parmi les chats restant, 7 avaient une PIF de forme humide et 5 une forme sèche. La dose de molnupiravir administrée le plus fréquemment était de 12 mg/kg PO BID et la durée médiane du traitement était de 12 semaines. Parmi les 26 chats traités avec du molnupiravir en deuxième intention, 24 étaient vivants lors de la publication de l’étude. Une amélioration clinique nette avait été notée 1 semaine après le début du traitement chez environ 50% des chats, et trois semaines après le traitement chez environ 90% des chats. Trois chats avaient présenté des effets secondaires, incluant de la nausée, des vomissements, une leucopénie (importante) et une altération de la rigidité du cartilage des pavillons auriculaires (un chat). Par ailleurs, 4 chats avaient reçu du molnupiravir en première intention, à une dose comprise entre 8 et 19 mg/kg PO BID et pendant 10 à 13 semaines. Tous les chats étaient en rémission lors de la publication, bien qu’un chat ait nécessité deux traitements consécutifs. Pour ces 4 chats, les propriétaires avaient déclaré avoir choisi le molnupiravir principalement en raison de son coût moins important (1045 dollars pour les environ 12 semaines de traitement avec molnupiravir versus 3450 dollars pour les 12 semaines de traitement avec GS-441524/remdesivir). Dans une autre étude prospective, 18 chats ayant une suspicion de PIF avaient été traités avec du molnupiravir (13 avec une forme humide et 5 avec une forme sèche, dont 3 avec des signes nerveux et/ou oculaires). Le molnupiravir avait été administré pendant 12 semaines et à la dose de : 10 mg/kg PO BID en cas de forme humide ; 15 mg/kg PO BID en cas de forme sèche ; 20 mg/kg PO BID en cas de signes nerveux/oculaires. Parmi les 18 chats traités, 4 sont décédés pendant la première semaine de traitement (tous ayant une PIF de forme humide), tandis que les 14 chats restants étaient tous en rémission 139 à 206 jours après la fin du traitement. Uniquement une augmentation transitoire et modérée des AlAT avait été notée pendant le traitement. A noter qu’une dose de 4 mg/kg PO SID à BID a été également suggérée pour les formes non nerveuses/non oculaires, ou une dose de 8-10 mg/kg PO BID pour les formes nerveuses/oculaires (pas d’étude scientifique à ce sujet) [2].
III- Le GC376
Le GC376 est un inhibiteur de la protéase 3CL, ayant été étudié chez des chats expérimentalement ou naturellement infectés par le FIPV. Dans l’étude de Pederson et al. (2018), 20 chats ayant une PIF (formes humide et sèche) diagnostiquée sur la base d’anomalies clinico-biologiques et d’une PCR (en ante- ou post-mortem) ont été traités avec du GC376 à la dose de 15 mg/kg SC BID. Aucun chat ayant des troubles nerveux a été inclus, en raison d’une mauvaise pénétration de ce médicament au sein du système nerveux central. Une nette amélioration clinique avait été notée chez 19 chats pendant les 4 premières semaines de traitement. Toutefois, plusieurs chats ont récidivé, nécessitant des nouveaux protocoles avec le GC376 et cela jusqu’à 12 semaines. Finalement, 13/20 chats sont décédés à la fin de l’étude et les restant 7 ont survécu au moins 12 semaines, mais sans une rémission (clinique ou biologique) complète. Les effets secondaires rapportés étaient une réaction au site d’injection et des anomalies de dentition chez les chatons en croissance. A noter que ce médicament n’est pas conseillé en cas d’atteinte oculaire, tout comme en cas d’atteinte nerveuse.
IV- Que faire en cas de résistance aux antiviraux/échec ?
Une résistance au GC376 et au GS-441524/remdesivir a été suspectée chez certains chats atteints de coronavirose systémique, particulièrement en cas d’affection nerveuse. Parfois, une augmentation de la dose d’antiviral peut résoudre/atténuer les signes cliniques, mais certains chats succombent à la maladie. De ce fait, des protocoles mixtes ont été proposés, bien que, à la connaissance de l’auteur, aucune étude n’ait été publiée à l’heure actuelle à ce sujet.
Combinaison de GS-441524 + GC376
En cas de résistance suspectée/avérée, la combinaison de GS-441524 (à la dernière dose utilisée lorsque la résistance a été suspectée et à administrer par voie SC) et de GC376 (à la dose de 20 mg/kg SC SID) pendant 8 semaines a été suggérée [2]. En cas d’échec, des augmentations de la dose de GC376 ont été suggérées (+10 mg/kg SC SID, jusqu’à un maximum de 50 mg/kg SC SID). Une nausée et un inconfort sont possibles tout au long du traitement. Aucune étude n’est disponible à ce jour concernant une possible combinaison de GS-441524 + molnupiravir, ou de GC376 + molnupiravir.
V- Le suivi clinique et biologique des chats traités avec des molécules antivirales pour la coronavirose systémique
Les constantes cliniques (état général, poids, appétit et température rectale), les anomalies nerveuses/oculaires et l'importance des effusions cavitaires sont les paramètres les plus importants à suivre pendant le traitement, avec des améliorations notables en quelques jours (pendant les 2 premières semaines de traitement, dans la grande majorité des cas). Une attention particulière est requise pour les signes nerveux, ces derniers pouvant apparaitre de novo pendant le traitement et pouvant indiquer la nécessité d’une augmentation de la dose d’antiviral. D’un point de vue biologique, l’hyperbilirubinémie, l’hyperprotidémie et les anomalies de la lignée blanche nécessitent environ 2 semaines pour s’améliorer (bien qu’une lymphocytose et/ou une éosinophilie puissent apparaître pendant l’administration du traitement antiviral). L’hyperglobulinémie, l’hypoalbuminémie et l’hématocrite s’améliorent plus tardivement et, parfois, peuvent rester anormaux à la fin du traitement. Une augmentation progressive du rapport albumine/globuline est notée tout au long du traitement en cas de bonne réponse. Une diminution notable de la concentration sérique en substance amyloïde A (SaA) est rapidement notée après le début du traitement antiviral chez un grand nombre de chats. A noter qu’un suivi des paramètres hépatiques (et principalement de la concentration plasmatique en AlAT) est à prévoir tout au long du traitement, ce paramètre augmentant fréquemment pendant l’administration des antiviraux. Enfin, une lymphadénomégalie persistante a été rapportée chez plusieurs chats en rémission et cela pendant un temps plus ou moins long après la fin du traitement antiviral. Son origine (réactionnelle, génétique ou secondaire à un « syndrome de PIF longue ») n’a pas été déterminée.
VI- Les facteurs pronostics dans le contexte du traitement antiviral
En prenant en compte tout type de forme de coronavirose (sèche, humide et mixte), la présence de signes nerveux (avant, pendant ou après le traitement) semblerait être un facteur pronostic négatif. Par ailleurs, l’hypothermie, la présence d’une anorexie/dysorexie et d’un abattement (et, éventuellement, d’une note d’état corporel basse) avant le début du traitement sembleraient influencer négativement la survie des chats traités. D’un point de vue biologique, une augmentation de la bilirubine totale (> 2 fois la normale) avant le traitement semblerait également être un facteur pronostique négatif. Une étude a suggéré qu’une diminution de l’a1-glycoprotéine acide pourrait différencier les animaux en rémission (avec PIF chronique) de ceux soignés. Enfin, une étude a avancé la possibilité que les chats de race Ragdoll pourraient répondre moins bien au traitement antiviral.
Il est important de surligner qu’aucune des molécules antivirales citées dans cette exposée est aujourd’hui approuvée, ni disponible en France. De ce fait, ni leur prescription, ni leur administration ne sont permises à ce jour.
Bibliographie
- https://vetmed.umn.edu/urolith-center/image-of-month/mysterious-new-stone-type-cats?fbclid=IwAR1XkCudpRXif75DbaZgGvWru7Km6Ymzpit8JvPnftLQXLcfFDikyAs9rAs
- https://sockfip.org/https-sockfip-org-wp-content-uploads-2022-03-approaches-to-drug-resistance-in-cats-treated-with-gs-441524-for-fip-v3-pdf/
Reste des références disponibles lors de la conférence orale.
