> Les maladies infectieuses du jeune - quel test choisir ?
Paris France
I- Introduction
Dans le contexte des maladies infectieuses, les examens complémentaires sont principalement représentés par des tests utiles pour confirmer la présence d’un agent infectieux dans l’organisme (cytologie, culture, examen des selles, PCR et tests antigéniques), ou par des tests visant à rechercher une exposition à un agent pathogène (recherche d’anticorps). Néanmoins, la recherche d’anticorps est particulièrement imparfaite car les anticorps peuvent persister longtemps après la résolution d’une infection ; la présence d’anticorps ne confirme pas le rôle de l’agent pathogène à l’origine des signes cliniques observés ; le résultat peut être faussement négatif en cas d’infection (hyper-)aigüe ; les animaux immunodéprimés peuvent être incapables de monter une réponse anticorpale. De ce fait, le choix des tests complémentaires en infectiologie dépendra de plusieurs facteurs, incluant l’agent infectieux en question, leur disponibilité et leurs caractéristiques intrinsèques. Ces dernières sont principalement représentées par : La sensibilité d’un test, soit la capacité d’un test de détecter un échantillon positif (majeure est la sensibilité d’un test, mineur sera le taux de faux-négatifs; La spécificité, soit la capacité d’un test de détecter un échantillon négatif (majeure est la specificité d’un test, mineur sera le taux de faux-positifs); La valeur prédictive négative (VPN), soit l’habilité d’un test de prédire l’absence d’une maladie; La valeur prédictive positive (VPP), soit l’habilité d’un test de prédire la présence d’une maladie. A noter que la VPP et la VPN sont influencées par la prévalence de la maladie en question.
II- Aperçu des principales techniques diagnostiques en infectiologie
1. La cytologie
La cytologie est un outil diagnostic pouvant être utile dans le diagnostic de différentes maladies infectieuses, incluant celles bactériennes, parasitaires, mycotiques et vectorielles. Toutefois, l’absence de visualisation d’un agent infectieux au sein de l’échantillon analysé (sang, selles, urines, fluides, cyto-ponction) ne permet pas d’infirmer une maladie infectieuse. La cytologie est alors un examen parfois peu sensible et avec une faible VPN.
2. La recherche d’antigènes
Un résultat positif à ces tests généralement confirme la présence d’un agent infectieux au sein de l’organisme. Toutefois, leur VPP est parfois faible. Par exemple, nombreux chats et chiens sains sont positifs pour la présence d’antigènes de Giardia duodenalis dans les selles (haute prévalence). De ce fait, un test antigénique positif dans les selles d’un animal ayant une diarrhée n’est pas un reflet de causalité.
3. La PCR
Cette technique est généralement considérée comme une des plus sensible (faible taux de faux-négatifs). Toutefois, sa sensibilité dépend de l’échantillon (plus faible dans les selles) et, dans certains cas, sa VPP est faible (la PCR étant capable de détecter à la fois les organismes vivants et non-vivants, ou inactifs). Par ailleurs, sa spécificité est fortement influencée par la méthode de collection de l’échantillon et par les procédures aux laboratoires (risque de contamination de l’échantillon). De plus, les résultats d’une PCR sont à interpréter en fonction du statut vaccinal de l’animal (certaines PCR amplifiant à la fois les souches pathogènes et celles vaccinales) et de la prévalence de l’agent infectieux au sein d’une population (par exemple, une PCR positive pour Herpesvirus ou Calicivirus sur un écouvillon conjonctival d’un chat présentant une atteinte oculaire/respiratoire haute ne preuve en aucun cas le rôle de ces agents dans le développement des signes cliniques).
4. La sérologie (recherche des anticorps)
Dans le cadre de la sérologie, la chronologie de la réalisation d’un test anticorpal est cruciale pour son interprétation. A titre d’exemple, les titres sérologiques des chiots et des chatons ne peuvent généralement pas être interprétés avant 8-12 semaines d’âge, en raison de la présence d’anticorps maternels transmis avec le colostrum. De plus, si un test sérologique recherchant uniquement des IgG est utilisé, un résultat faux-négatif est possible pendant les 2 premières semaines post-infection. Dans ce cas, la documentation d’une séroconversion (test résultant positif environ 15 à 21 jours après la réalisation du premier) ou de l’augmentation du titre anticorpal sont nécessaires pour le diagnostic. D’un autre côté, un résultat positif est à interpréter en fonction du tableau (clinique, biologique et paramédical) global, puisqu’une sérologie positive ne prouve pas la présence d’un agent infectieux, mais uniquement une exposition (récente ou ancienne) à ce dernier. A titre d’exemple, certains chats peuvent avoir des titres sérologiques pour Toxoplasma gondii très élevés (supérieurs à 1 :16384) des années après avoir été infectés. Dans ce cas, la différenciation des IgM versus IgG peut être utile au diagnostic.
III- Diagnostic des principales maladies infectieuses du jeune animal
1. La parvovirose
Les principaux tests utilisés pour le diagnostic de la parvovirose sont l’ELISA (recherche d’antigènes fécaux) et la PCR sur selles. Les tests antigéniques disponibles pour le chien sont également réalisables chez le chat. La PCR est à privilégier, compte-tenu de la très faible sensibilité des tests ELISA, mais également de leur spécificité imparfaite (les tests ELISA pouvant être faussement positifs les 10 jours suivant la vaccination chez le chien et les 15 jours suivants chez le chat). Une étude récente portant sur 150 chiens a évalué les caractéristiques intrinsèques de 8 tests ELISA pour la parvovirose réalisables au chevet du patient, en les comparant à la PCR sur selles (« gold standard » de l’étude). Les 8 tests avaient une spécificité et une VPP de 100% (absence de faux positifs). Toutefois, la sensibilité de ces tests était très faible (grand nombre de faux négatifs), variant entre 22,9% et 34,3%. Chez le chat, une étude plus ancienne a rapporté une VPP des tests antigéniques fécaux variant entre 38,9% et 100% et une VPN variant entre 97,4% et 98,4%. La PCR, quant à elle, peut présenter une spécificité imparfaite, découlant principalement de la chronologie vaccinale. A ce sujet, Segev et al. (2022) ont évalué 44 chiots avant vaccination et 16 chiots après vaccination avec un vaccin vivant atténué. Avant vaccination, uniquement 1/44 chiot était positif pour le parvovirus, tandis que 10 jours après la première injection jusqu’à 62% des 16 chiots était positif sur selles pour le parvovirus. Toutefois, 12 jours et 28 jours après la deuxième injection, 12/16 chiots étaient négatifs.
2. La giardiose
Giardia duodenalis est un protozoaire fréquemment rencontré chez les chiens et les chats, étant la plupart du temps sous-clinique mais pouvant également induire une diarrhée aigüe ou chronique. Son diagnostic de certitude est néanmoins difficile pour l’imperfection des tests complémentaires à notre disposition (par exemple, la flottation est limitée par la présence peu fréquente des trophozoïtes dans les selles diarrhéiques et par une excrétion protozoaire intermittente. Afin d’augmenter la sensibilité des tests diagnostiques pour la giardiose (sans pour autant pouvoir en assurer la VPP), le « Companion Animal Parasite Council » conseille d’utiliser à la fois la flottation et un test rapide dans la pratique courante (et malgré le fait qu’aujourd’hui le test retenu le plus sensible soit l’immunofluorescence (IF)).
3. La trichomonose
Le diagnostic de la trichomonose repose sur différentes techniques, incluant l’analyse au microscope d’un étalement fécal, la culture fécale en milieu spécifique (inPouch TF Feline ND) et la PCR sur selles. Toutefois, la sensibilité des deux premières techniques est faible (14% pour l’examen des selles et 55% pour la culture fécale), tout comme leur spécificité (due à l’impossibilité de différencier T. fœtus de Pentatrichomonas hominis, ce dernier non pathogène chez le chat). Par ailleurs, des co-infections avec G. duodenalis sont rapportées dans le 22% à 54% des cas, et la différenciation des trophozoïtes des deux protozoaires est délicate. De ce fait, la PCR est aujourd’hui la méthode de choix. Toutefois, la sensibilité de cette dernière dépend de la méthode de prélèvement (augmentant lorsque les selles sont prélevées par lavement du colon proximal à l’aide d’une solution stérile de NaCl 0,9% et envoyées au laboratoire rapidement et sans couverture de froid).
4. La coronavirose systémique
Dans le parcours diagnostic, les examens complémentaires de première intention doivent inclure une analyse urinaire, un hémogramme, une biochimie sanguine et un test FIV/FeLV. Ensuite, d’autres examens complémentaires sont nécessaires afin de confirmer/infirmer le diagnostic.
a) L’examen physico-chimique et cytologique du liquide d’épanchement
En aucun moment la présence d’un liquide d’épanchement macroscopiquement jaunâtre est diagnostique d’une « PIF ». Généralement, ce liquide aura les caractéristiques d’un transsudat modifié (cellularité < 5 x 109 cells/L) riche en protéines (> 35 g/L). Lors de l’examen cytologique, une inflammation pyo-granulomateuse (polynucléaires neutrophiles et macrophages) est retrouvée, bien que des épanchements chyleux aient également été rapportés.
b) La sérologie (recherche d’anticorps sur sang périphérique)
La sérologie n’a pas de place dans le diagnostic de la « PIF » (qu’elle soit réalisée sur sérum ou fluides), car les anticorps peuvent être retrouvés chez des chats sains, chez des chats malades (mais sans « PIF »), tout comme chez des chats ayant une « PIF ». La sérologie souffre également d’un manque de spécificité, surtout lors de formes nerveuses.
c) La RT-PCR
La recherche du FCoV par PCR (amplifiant le gène pour la protéine « M ») peut être réalisée sur sang, fluides (effusions, liquide cérébro-rachidien (LCR), humeur aqueuse), sur cytoponction ou sur un tissu. Son utilisation sur un échantillon fécal n’a aucune utilité dans le cadre de la démarche diagnostique de la « PIF », car jusqu’à 90% des chats sont positifs puisque porteurs du virus. Par ailleurs, il est à surligner que la détection du FCoV sur sang périphérique, fluide ou tissu n’est pas forcément diagnostique d’une « PIF », puisque le FECV (non virulent) peut être retrouvé dans ces échantillons. Une PCR spécifique pour la mutation de la protéine « S » est également disponible. Toutefois, sa sensibilité et sa spécificité sont controversées et il est déconseillé de réalisée cette technique de façon isolée (une PCR « multiplex », recherchant à la fois le FCoV et son éventuelle mutation de la protéine « S », est à privilégier).
d) L’immunocytochimie et l’immunohistochimie
Ces techniques permettent la visualisation du complexe anticorps-cellule exprimant l’antigène du FCoV. L’IHC est à ce jour le « gold standard » pour le diagnostic de la « PIF ». Elles peuvent être réalisées sur les fluides et cytoponctions (ICC), ou sur du tissu (IHC). A noter toutefois que la sensibilité est imparfaite, un résultat négatif n’écartant pas la maladie.
Bibliographie
- Gookin JL et al. The conundrum of feline Trichomonosis :The more we learn the ‘trickier’ it gets. J Fel Med Surg 2017;19: 261-274.
- Lappin MR. Infectious Disease Diagnostic Assays. Top Companion Anim Med 2009;24 :199-208.
- Neuerer FF et al. Comparison of different in-house test systems to detect parvovirus in faeces of cats. J Fel Med Surg 2008;10: 247-251.
- Segev G et al. Effect of sampling site on the diagnosis of canine parvovirus infection in dogs using polymerase chain reaction. J Vet Intern Med 2022;36: 591-598.
- Thayer V et al. 2022 AAFP/EveryCat Feline Infectious Peritonitis Diagnosis Guidelines. J Fel Med Surg 2022;24: 905-933.
- Walter-Weingärtner J et al. Comparison of Eight Commercially Available Faecal Point-of-Care Tests for Detection of Canine Parvovirus Antigen. Viruses 2021; 13: 2080.
> Particularités biochimiques du jeune
Saint-Laurent-Du-Var France
I- Introduction
Le jeune chat et le jeune chien présentent, notamment dans les premiers mois de la vie, des capacités fonctionnelles limitées, inférieures à celles de l’adulte, pour de nombreux organes en raison de l’immaturité de ces derniers à la naissance. Au fur et à mesure que l’animal grandit, ces capacités fonctionnelles augmentent pour rejoindre celles de l’adulte. Ceci peut se traduire pour certaines variables biologiques (substrats, enzymes) par des concentrations ou des activités différentes de celles de l’adulte.
Le but de cette présentation est de présenter ces principales particularités biochimiques du jeune et leurs répercussions sur l’interprétation de ces variables biologiques. Il faut noter que les articles concernant ces données sont peu nombreux et basés souvent sur de faibles effectifs en utilisant souvent des chiots ou chatons d’une même race.
Des intervalles de références issus seront donnés, mais restent à interpréter avec précaution, car ces intervalles ont été parfois construits sur des chiots ou des chatons d’une même race et/ou sur de faibles effectifs. Il faut également rappeler que les intervalles de référence devraient être construits pour chaque type d’automate ; les intervalles de référence pour une même variable biologique pouvant varier selon la méthode analytique utilisée.
II- Glucose
Les chiots et chatons présentent à la fois un foie immature et une régulation de la glycémie moins efficace que l’adulte. Ceci a des répercussions sur la glycémie.
Chez le chiot, les concentrations en glucose sont plus basses que chez l’adulte immédiatement après la naissance, puis augmentent significativement après 3 jours. Cette faible concentration
est probablement la conséquence d’une fonction hépatique et d’un système de régulation de la glycémie encore immature. La glycémie reste haute, souvent supérieure à l’intervalle de référence de l’adulte jusqu’à 6 à 9 mois.
Chez le chaton, les concentrations en glucose sont élevées dès la naissance et rejoignent celles de l’adulte au sevrage.
III- Enzymes hépatiques (PAL, GGT, ASAT, LDH), bilirubine, et acides biliaires
L’immaturité fonctionnelle du foie chez le jeune, le trauma lié à la naissance, l’ingestion de colostrum, la croissance (osseuse notamment) et la maturation de certaines voies métaboliques font que le niveau d’activité des enzymes hépatiques mesurées chez le jeune diffère de celles de l’adulte.
L’activité des PAL, AST, GGT, LDH (et CK) est généralement très élevée 24 h après la naissance en raison de l’ingestion de colostrum. Ces valeurs élevées d’activité persistent généralement pendant 10 à 14 jours puis diminuent progressivement. Chez le chaton, l’activité des PLA, CK et LDH reviennent dans l’intervalle de référence de l’adulte vers 8 semaines. La mesure de l’activité des PAL chez le chaton et le chiot, et, dans une moindre mesure des GGT chez le chiot, permet d’évaluer la prise adéquate de colostrum. L’intervalle de référence pour la GGT est le même pour le chaton et le chat adulte.
L’activité des PAL reste élevée plus longtemps en raison de la croissance et du métabolisme osseux. En effet, on retrouve dans le sang une plus grande quantité de PAL d’origine osseuse (synthétisées par les ostéoblastes) chez le jeune que chez l’adulte. L’activité des PAL revient dans l’intervalle des valeurs usuelles entre l’âge de 1 et 2 ans.
Chez le chien les nouveau-nés (1 à 3 jours) présentent une concentration en bilirubine plus élevée que celle de l’adulte ; cette concentration diminue ensuite rapidement pour atteindre les valeurs de l’adulte. Chez le chaton, on observe également une concentration plus élevée que celle de l’adulte durant la première semaine de vie.
Les études n’ont pas mis de différences significatives entre les concentrations en acides biliaires chez le jeune chien ou chaton et l’adulte.
IV- Calcium, phosphore
Le calcium et le phosphore présentent des concentrations élevées chez le jeune comparativement à l’adulte ; ceci est principalement lié à la forte activité du métabolisme osseux pendant la croissance. Il faut également noter que pendant la lactation, l’absorption de calcium et phosphore est stimulée en raison de la présence de PTH-rp (PTH-related protein) et d’hormone de croissance (GH).
Chez le chiot, la concertation en calcium total atteint un pic vers 8 semaines et reste supérieure à l’intervalle de référence de l’adulte jusqu’à environ 1 an. Une étude à montrer que la concentration en calcium ionisé était supérieure à celle de l’adulte jusqu’à au moins 84 jours (dernière date de mesure de l’étude).
Chez le chaton, la calcémie est également plus élevée que chez l’adulte, mais atteint les valeurs de l’adulte vers 3 mois.
Les concentrations en phosphore sont également supérieures à ce qui est observé chez l’adulte ; elles rejoignent les concentrations de l’adulte vers 1 ans aussi bien pour le chiot que pour le chaton.
V- Urée, créatinine, SDMA
Chez le chiot, les études ont montré une concentration en urée dans l’intervalle de référence de l’adulte à la naissance puis une baisse de la concentration entre 2 et 12 semaines ; cette concentration revient dans l’intervalle de référence de l’adulte vers 6 mois. Cette concentration plus basse pourrait être la conséquence de l’immaturité fonctionnelle du foie et du rein.
Chez le chaton, on observe une concentration en urée plus basse que celle de l’adulte chez les chatons de moins de 8 semaines puis une remontée de cette concentration pour atteindre rapidement celle de l’adulte.
Concernant la créatinine, sa concentration est variable, souvent élevée, chez le nouveau-né canin, puis baisse jusqu’à l’âge de 30 jours ; elle augmente ensuite progressivement jusqu’à l’âge d’un an. Comme chez le chien, les chatons nouveau-nés, présentent une concentration en créatinine élevée à la naissance qui diminue ensuite jusqu’à l’âge de 8 semaines pour atteindre une concentration dans l’intervalle de référence de l’adulte ou en dessous.
L’intervalle de référence de la SDMA est rapporté comme étant plus élevé (0–16 ug/dL) que celui de l’adulte (étude interne Idexx) chez le chiot alors qu’il est le même (0–14ug/dL) que l’adulte pour le chaton.
VI- Protéines totales, albumine, globulines
La concentration en protéines totales est basse à la naissance et augmente significativement après la prise de colostrum ; cette concentration diminue ensuite pendant une à deux semaines au fur et à mesure que le colostrum est métabolisé. La concentration en protéines totales augmente ensuite progressivement pour atteindre celle d’adulte entre l’âge de 6 mois et 1 an.
Chez le chien, la concentration en albumine est plus basse que celle de l’adulte jusqu’à l’âge de 4 semaines. À 8 semaines, cette concentration se situe dans l’intervalle de référence de l’adulte. Les données sont plus parcellaires chez le chat, mais la concentration en albumine semble rapidement atteindre celle de l’adulte.
Les chiots possèdent peu d’anticorps à la naissance ce qui se traduit par une concentration en globulines basses. Des globulines sont ensuite ingérées via le colostrum, mais la concentration en globulines reste généralement inférieure à celle de l’adulte jusqu’à l’âge d’un an environ. Une situation comparable s’observe chez le chaton.
VII- Triglycérides, cholestérol
Chez le nouveau-né, l’apport de lipides est essentiellement alimentaire ; le foie présente en effet une capacité de synthèse limitée. Au cours de la première année de vie, cette concentration en lipides est le plus élevée durant les 8 premières semaines de semaines de vie, puis diminue après le sevrage pour atteindre rapidement celle de l’adulte.
VIII- Potassium, sodium, chlore
Une étude portant sur 68 chiots a montré une concentration en potassium plus élevée et des concentrations en sodium et chlore plus basses que chez l’adulte à l’âge de 4jr jusqu’à l’âge de 84 jr. Une autre étude rapporte une kaliémie basse à l’âge de 2 à 4 semaines puis un pic à l’âge de 6-8 semaines.
Les données sont plus floues chez le chaton. La kaliémie serait légèrement plus basse chez le chaton de moins de 3 mois comparé aux chatons plus âgés ; la kaliémie augmenterait légèrement entre 4 et 6 mois pour atteindre des valeurs comparables à l’adulte vers 6 mois. La chlorémie serait la plus basse chez les chatons de moins de 3 mois puis augmenterait progressivement pour atteindre les valeurs de l’adulte vers 4 à 6 mois.
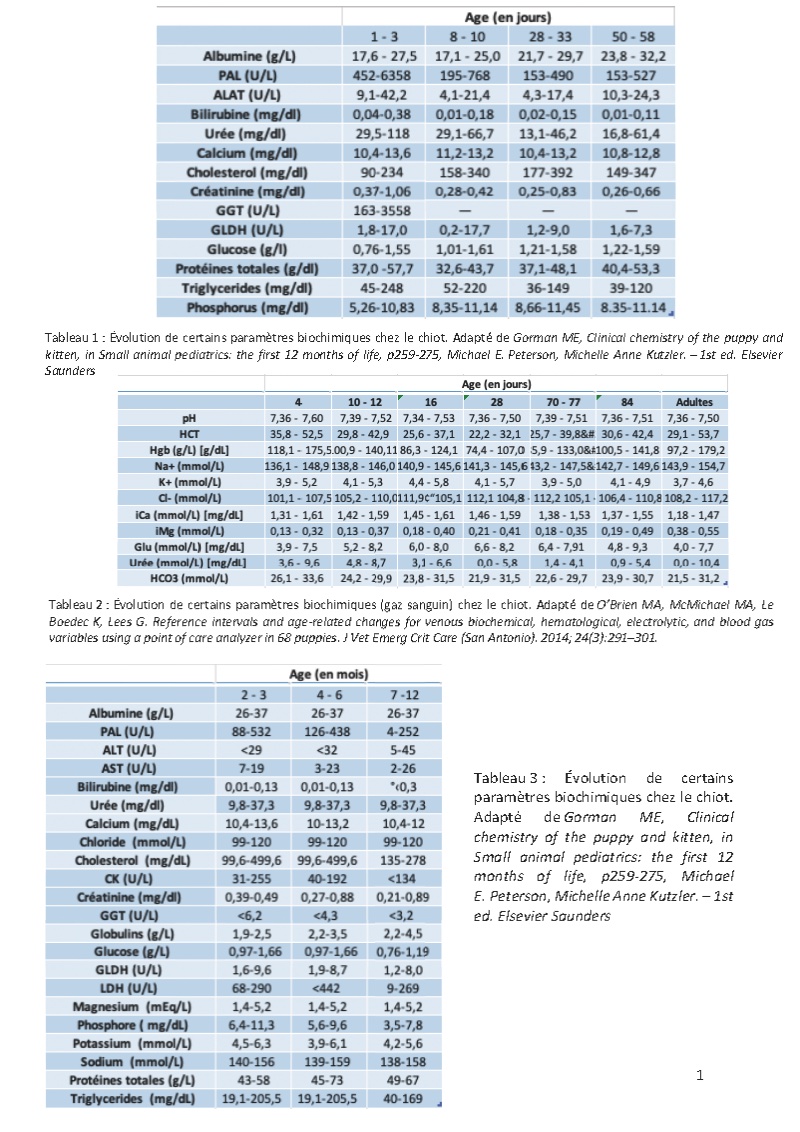
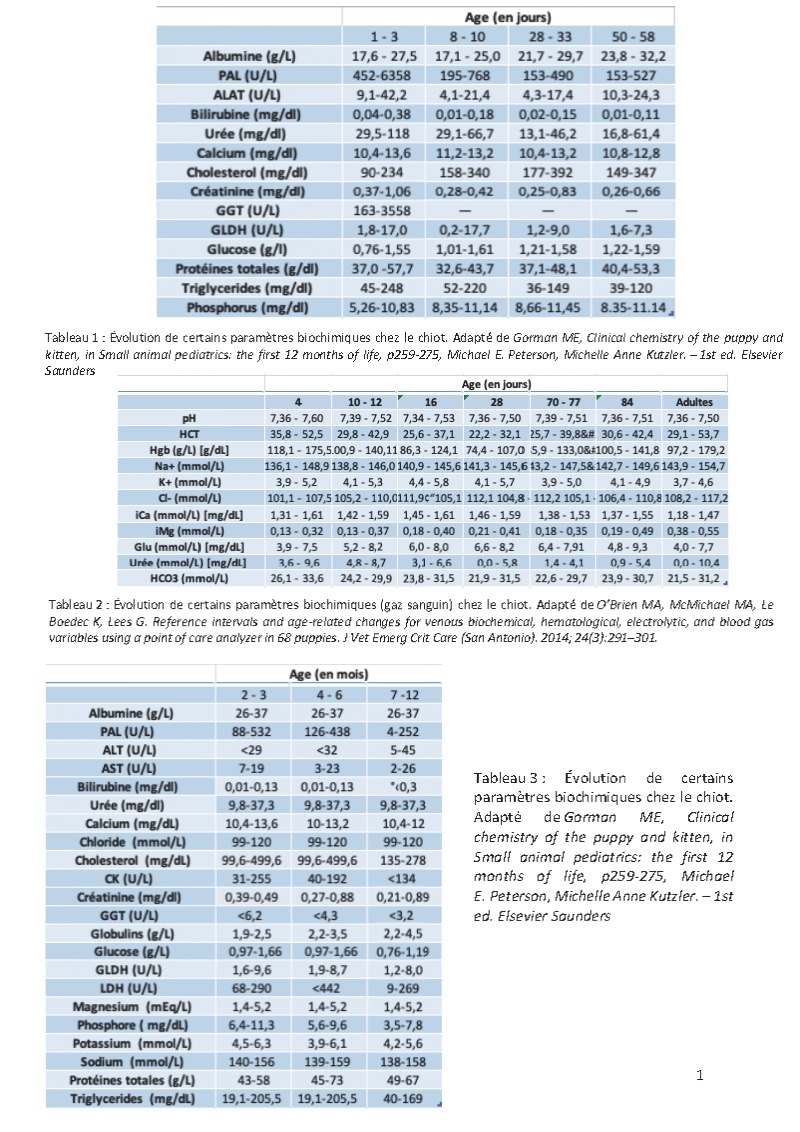
Bibliographie
- Gorman ME, Clinical chemistry of the puppy and kitten, in Small animal pediatrics: the first 12 months of life, p259-275, Michael E. Peterson, Michelle Anne Kutzler. – 1st ed. Elsevier Saunders/li>
- O’Brien MA, McMichael MA, Le Boedec K, Lees G. Reference intervals and age-related changes for venous biochemical, hematological, electrolytic, and blood gas variables using a point of care analyzer in 68 puppies. J Vet Emerg Crit Care (San Antonio). 2014; 24(3):291–301.
- Rørtveit R, Saevik BK, Eggertsdóttir AV, Skancke E, Lingaas F, Thoresen SI, Jansen JH. Age-related changes in hematologic and serum biochemical variables in dogs aged 16–60 days. Vet Clin Pathol. 2015 Mar; 44(1):47–57. doi: 10.1111/
- Rosset E, Rannou B, Casseleux G, Chalvet-Monfray K, Buff S. Age-related changes in biochemical and hematologic variables in Borzoi and Beagle puppies from birth to 8 weeks. Vet Clin Pathol. 2012 Jun; 41(2):272-82. doi: 10.1111
- von Dehn B. Pediatric clinical pathology. Vet Clin North Am Small Anim Pract. 2014 Mar; 44(2):205-19. doi: 10.1016
> Particularités hématologiques du jeune
Saint-Laurent-Du-Var France
I- Introduction
Le développement du jeune, chiot et chaton notamment, s’accompagne d’adaptations physiologiques qui vont avoir des répercussions sur les données biologiques de ces animaux. Le but de cette présentation est d'exposer ces principales particularités hématologiques du jeune et leurs répercussions sur l’interprétation de ces variables biologiques. Il faut noter que les articles concernant ces données sont peu nombreux et basés souvent sur de faibles effectifs en utilisant souvent des chiots ou chatons d’une même race.
Des intervalles de références seront donnés mais restent à interpréter avec précaution, car ces intervalles ont été parfois construits sur des chiots ou des chatons d’une même race et/ou sur de faibles effectifs. Il faut également rappeler que les intervalles de référence devraient être construits pour chaque type d’automate ; les intervalles de référence pour une même variable biologique pouvant varier selon la méthode analytique utilisée.
II- Lignée rouge
Le nombre de globules rouges (GRs), la concentration en hémoglobine (Hgb) et l’hématocrite (Hct) sont significativement plus bas chez le jeune que chez l’adulte puis remontent progressivement lors de la croissance de l’animal. Plus précisément, il est rapporté que ces paramètres diminuent après la naissance pour atteindre un minimum autour de 2 semaines pour GRs, et de 4 à 6 semaines pour l’Hgb et l’Hct pour ensuite augmenter progressivement. Dans une étude incluant des Beagles et des Labradors Retrievers 1, ces variables biologiques atteignent les intervalles de l’adulte à l’âge d’un an. Ces paramètres sont rapportés comme atteignant l’intervalle de référence de l’adulte entre 2 et 6 mois chez le chaton.
En raison de la présence d’érythrocytes fœtaux, plus gros que les érythrocytes produits après la naissance, le volume globulaire moyen (VGM) est plus élevé chez le chiot et le chat. Le VGM diminue ensuite progressivement au fur et à mesure que les érythrocytes fœtaux disparaissent ; le VGM atteint l’intervalle de référence de l’adulte entre 2 et 4 mois.
La concentration corpusculaire moyenne en hémoglobine (CCMH) et la teneur moyenne en hémoglobine (TCMH) sont similaires entre le jeune et l’adulte dans la majorité des études publiées.
En raison d’une érythropoïèse soutenue, le nombre de réticulocytes est rapporté comme plus élevé chez le chiot (pas de données chez le chaton) durant les deux premiers mois. Le nombre de réticulocytes diminue ensuite pour atteindre les valeurs de l’adulte vers l’âge de 5 à 6 mois.
Conséquence clinique :
Une anémie régénérative pourra être faussement diagnostiquée chez le jeune (moins de 2 à 4 mois) si les intervalles de référence de l’adulte sont utilisés pour interpréter les résultats d’une numération-formule.
III- Lignée blanche
Le comptage leucocytaire des chiots et chatons se situe généralement dans l’intervalle de référence de l’adulte.
Chez le chiot, le comptage de granulocytes neutrophiles segmentés se situe dans le même intervalle de référence que chez l’adulte et ce, dès à la naissance. Le nombre de lymphocytes est lui souvent plus élevé chez le chiot que chez l’adulte ; les chiots de moins de 6 mois ont ainsi souvent un comptage en lymphocytes dépassant les 2000 lymphocytes/uL avec des comptages atteignant 10 000 lymphocytes/uL
Une étude de 1973 rapporte la présence de granulocytes neutrophiles non segmentés chez des chiots de 0 à 3 jours.
Chez le chaton, le comptage leucocytaire et celui des lymphocytes sont souvent au-dessus de l’intervalle de référence de l’adulte entre 2 et 4 mois d’âge. Ces comptages sont revenus dans l’intervalle de référence de l’adulte vers l’âge de 5-6 mois.
IV- Lignée plaquettaire
Il n’est pas rapporté de différences entre le jeune et l’adulte pour les paramètres plaquettaires chez le chien et le chat.
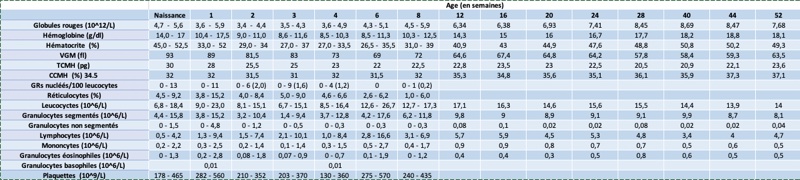
Tableau 1
Bibliographie
- Bird KE, The Hematologic and Lymphoid Systems, in Small animal pediatrics: the first 12 months of life, p306-327, Michael E. Peterson, Michelle Anne Kutzler. – 1st ed. Elsevier Saunders
- O’Brien MA, McMichael MA, Le Boedec K, Lees G. Reference intervals and age-related changes for venous biochemical, hematological, electrolytic, and blood gas variables using a point of care analyzer in 68 puppies. J Vet Emerg Crit Care (San Antonio). 2014; 24(3):291–301.
- Rørtveit R, Saevik BK, Eggertsdóttir AV, Skancke E, Lingaas F, Thoresen SI, Jansen JH. Age-related changes in hematologic and serum biochemical variables in dogs aged 16–60 days. Vet Clin Pathol. 2015 Mar; 44(1):47–57. doi: 10.1111/
- Rosset E, Rannou B, Casseleux G, Chalvet-Monfray K, Buff S. Age-related changes in biochemical and hematologic variables in Borzoi and Beagle puppies from birth to 8 weeks. Vet Clin Pathol. 2012 Jun; 41(2):272-82. doi: 10.1111
- Shifrine M, Munn SL, Rosenblatt LS, et al. Hematologic changes to 60 days of age in clinically normal Beagles. Lab Anim Sci 1973; 23:894 – 898.
- von Dehn B. Pediatric clinical pathology. Vet Clin North Am Small Anim Pract. 2014 Mar; 44(2):205-19. doi: 10.1016
