> Apport du dispositif "free style" pour le diagnostic et le suivi d'un insulinome canin, à propos d'un cas
Anamnèse et commémoratifs
Une chienne berger blanc suisse de 11,5 ans est présentée chez son vétérinaire traitant pour une fatigue à l'effort, la chienne se couchant soudain en milieu de balade, depuis 2 à 3 semaines. Elle est correctement vaccinée et vermifugée et sous ciclosporine depuis 7 ans pour fistules anales en rémission (3,3 mg/kg un jour sur 2).
Clinique
Une analyse biochimique montre une hyperglobulinémie et une hypoglycémie (Alb/Glob=0,6; 0,57 g/L). La numération formule est sans anomalie. La chienne est placée sous AINS et flexadin, sans réponse au traitement.
La glycémie recontrôlée 7 jours plus tard est toujours basse. La chienne est alors référée, 5 semaines après le début des symptômes. Ceux-ci se sont aggravés avec fatigue, ataxie, et chutes régulières pendant des promenades pourtant très courtes (100 m). La chienne n'est pas en hypoglycémie au moment de la visite, deux jours de suite.
Un dispositif free style est alors mis en place afin de repérer les moments éventuels d'hypoglycémie, qui interviennent seulement mais systématiquement à l'effort, au moment de la courte sortie (100m) du matin. La mesure d'insulinémie réalisée lors d'une phase d'hypoglycémie (0,57 g/L, insulinémie 9 UI/L) permet de suspecter un insulinome, et un examen tomodensitométrique (3 phases, arterielle, artérioveineuse et veineuse), révéle une très petite masse hypodense non réhaussante au niveau du pancréas. Cette image étant peu compatible avec un insulinome, la chienne est placée sous diazoxide à doses progressivement augmentées (de 4,8 mg/kg/j à 8,3 mg/kg/j) et sa glycémie suivie au freestyle.
Deux mois plus tard, la chienne est de plus en plus gênée par sa fatigue à l'effort, et les hypoglycémies toujours suivies au freestyle ont augmenté en fréquence et en sévérité. Un nouvel examen tomodensitométrique révèle de nouveau un nodule hypoatténuant, sur le corps du pancréas, juste ventralement à la veine pancréatico-duodénale et dorsalement à l'artère pancréatico-duodénale, bien délimité et uniquement rehaussé en périphérie, de 12 mm de diamètre, d'aspect similaire sur les 3 phases (même emplacement que la première fois, mais de taille augmentée).
Les noeuds lymphatiques hépatiques sont de taille habituelle, deux nodules hypoatténuants sont présents sur le foie, ainsi que de nombreuses plages hyperatténuantes sur les trois phases post contrastes dans la rate.
La chienne est opérée (5,5 mois après le début des symptômes). La rate, d'aspect léopard, est retirée, ainsi que la tumeur pancréatique, remontant en cordon le long du corps du pancréas, avec un embole massif de la veine pancréatique. La chirurgie pancréatique ayant été longue et complexe, avec un risque majeur de nécrose pancréatique, les 2 nodules hépatiques visibles ont été laissés en place.
Un insulinome malin est confirmé à l'analyse histologique, avec des marqueurs de l'insuline positifs en immunohistochimie, mais les modifications spléniques observées n'étaient pas d'origine cancéreuse.
Suivi
La récupération post-opératoire est rapide et la chienne maintenue sous proglicem (11,5 mg/kg/j) plus toceranib (2,3 mg/kg 1j/2). Le suivi par le biais d'un dispositif freestyle montre l'absence d'hypoglycémies dès après la chirurgie ; la chienne reprend une activité normale sans fatigue à l'effort et reprend son poids de forme en quelques semaines (+10%). Des contrôles réguliers sanguins biochimiques, de NF et bandelette urinaire ne montrent pas d'effets secondaires au traitement. La chienne est cliniquement normalisée depuis 3 mois.
Discussion
Ce cas montre l'intérêt du dispositif free style pour le diagnostic de l'insulinome (ayant permis de sélectionner la bonne heure de prélèvement pour effectuer le dosage couplé glycémie/insulinémie), le suivi des phases d'hypoglycémies, allant en s'aggravant avant la chirurgie, ayant motivé un second examen tomodensitométrique avec établissement du diagnostic, et ayant permis le suivi postchirurgical avec la mise en évidence de la rémission immédiate des hypoglycémies après la chirurgie, malgré l'absence de retrait de deux nodules hépatiques suspects.
Le dispositif free style a aussi permis de vérifier l'absence de diabète, possible en post opératoire.
Le second point d'intérêt de ce cas réside dans la difficulté diagnostique de l'insulinome à l'imagerie, le premier examen tomodensitométrique n'ayant pas permis la localisation d'une masse caractéristique d'insulinome sur le pancréas malgré l'examen aux trois temps, artériel, artérioveineux et veineux. L'aspect hypodense sur les 3 phases était probablement compatible avec l'embole vasculaire constaté en chirurgie.
Le second examen tomodensitométrique n'avait pas non plus permis d'anticiper le cordon cancéreux rattaché à cet embole, et avait entrainé la suspicion de métastases spléniques (non avérées à l'analyse histologique), confirmant que la sensibilité et spécificité de l'examen tomodensitométrique sont faibles.
Le pronostic après chirurgie reste réservé dans tous les cas, avec un risque majeur d'émergence de métastases à distance et une survie médiane de 1 à 2-3 ans, selon le traitement médical appliqué au moment des rechutes, et selon les publications. Le tocéranib semble montrer un intérêt pour repousser l'émergence des métastases, mais peu de cas ont été publiés. Dans notre cas, avec 3 mois de recul, la chienne présente après sa chirurgie et sous traitement une excellente qualité de vie sans effets secondaires notables, malgré l'embole vasculaire massif constaté en chirurgie.
> Complications et survie à long-terme de la mise en place de dispositifs de dérivation pyélo-vésicale extra-urétérale : étude rétrospective de 94 cas (2014 - 2021)
Introduction
Les obstructions urétérales représentent depuis plusieurs années une problématique majeure en médecine féline. L'urétérolithiase en est de loin la cause la plus fréquente.
Face aux limites de la prise en charge médicale, de nombreuses options chirurgicales ont été développées. Parmi elles, la mise en place de dispositifs de dérivation pyélo-vésicale extra-urétérale apparait actuellement comme le traitement de choix. Malgré un intérêt croissant au cours des dernières années et un meilleur recul concernant la tolérance au long cours de tels dispositifs, des fréquences de complications et des durées de survie variables ont été rapportées.
Dans ce contexte, les objectifs de cette étude étaient de décrire les complications et les résultats à long-terme suite à la mise en place de dispositifs de dérivation pyélo-vésicale extra-urétérale dans une grande cohorte de chats et d'identifier d'éventuels facteurs influençant la survie.
Matériels et méthodes
Dans cette étude rétrospective, ont été inclus les chats ayant bénéficié de la pose de dispositifs de dérivation pyélo-vésicale extra-urétérale pour le traitement d'obstruction urétérale de cause bénigne entre 2014 et 2021 dans deux centres hospitalo-universitaires. Les données cliniques, paracliniques, thérapeutiques et de suivi de chaque cas ont été recueillies.
Les complications liées aux dispositifs ont été classées en fonction de leur gravité (majeure si elles ont nécessité une nouvelle intervention chirurgicale et/ou ont entrainé le décès versus mineure) et du moment de leur survenue, c'est-à-dire en période peropératoire (jusqu'à 8h après l'intervention), en cours d'hospitalisation, à court-terme (de la sortie d'hospitalisation à 3 mois post-opératoire), ou à long-terme (≥ 3 mois post-opératoire).
Une analyse de survie a été conduite par le biais de l'estimateur de Kaplan-Meier et les fonctions de survie obtenues ont été comparées par le test du Log-Rank.
Résultats
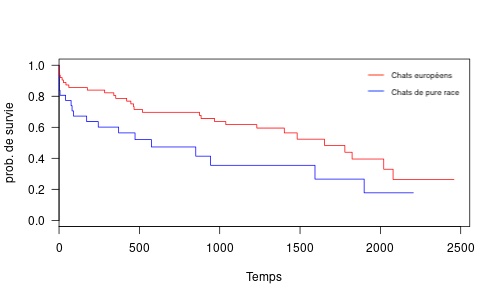
Quatre-vingt-quatorze chats, dont 33% de pure race, ont été inclus, avec un âge médian de 6 ans [1er quartile Q1 : 3, 3ème quartile Q3 : 8]. Un dispositif unilatéral a été mis en place dans 64% des cas et un dispositif bilatéral dans 36%. Le prix médian de l'intervention et de l'hospitalisation post-opératoire était de 2022 euros.
La durée médiane d'hospitalisation était de 5 jours et le taux de mortalité hospitalière de 12%. Des complications ont été observées dans 83% des cas, qu'elles aient été majeures (41% des cas) et/ou mineures (73%). Douze chats sur 90, 25/89, 43/77 et 51/66 ont développé des complications respectivement en période peropératoire, en cours d'hospitalisation, à court-terme et à long-terme.
Les complications les plus fréquemment rencontrées à long-terme étaient : des minéralisations au sein du dispositif et la présence d'une bactériurie dans 41% des cas chacune, des épisodes de cystite mécanique dans 33% des cas, des problèmes techniques avec le dispositif (coudure, débricolage, etc.) dans 18% des cas, l'invagination du dispositif au sein d'un segment de l'intestin grêle et le développement d'un abcès périrénal dans 8% des cas chacun. Dans l'ensemble, 26% des cas ont nécessité au moins une nouvelle intervention, pour un total de 30 reprises.
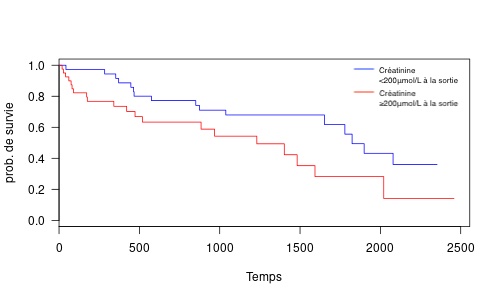
Le temps de suivi médian était de 540 jours [Q1 : 187, Q3 : 1209] et la moyenne des coûts du suivi était de 1187 euros par an. La médiane de survie globale était de 1482 jours (intervalle de confiance à 95% : 884 - 1899), avec un taux de survie à 3 ans de 54%.
Une créatininémie ≥200 μmol/L à la sortie d'hospitalisation (p = 0,045) et l'appartenance à une lignée de race (p = 0,036) étaient associées significativement à une survie réduite.
Discussion
Dans cette large cohorte de cas, la mise en place de dispositifs de dérivation pyélo-vésicale extra-urétérale a été associée à un taux de survie satisfaisant à court-terme mais s'est accompagnée de complications post-opératoires variées et potentiellement graves. Des complications majeures sont survenues dans presque 1 cas sur 2 et une reprise chirurgicale a été nécessaire dans 1 cas sur 4.
Si ces données sont relativement comparables à celles de la littérature, le taux de complications à long-terme dans notre étude est globalement plus élevé que ceux rapportés récemment. Malgré tout, la survie globale de notre population est l'une des plus longues rapportées à ce jour, illustrant de très bons résultats à long terme.
Conclusion
Lors d'obstruction urétérale avérée, la mise en place de dispositifs de dérivation pyélo-vésicale extra-urétérale est salvatrice et permet une survie prolongée dans la plupart des cas. Elle s'accompagne toutefois de nombreuses complications au long cours. Si ces dernières sont gérables dans la plupart des cas, elles imposent néanmoins un suivi médical régulier et un investissement financier important. Ces éléments doivent donc être discutés avec les propriétaires et l'indication d'une dérivation confirmée avant l'intervention.
Bibliographie
- Kulendra NJ, et al. Survival and complications in cats treated with subcutaneous ureteral bypass. J Small Anim Pract. 2021 Jan;62(1):4-11.
- Vrijsen E, et al. Complications and survival after subcutaneous ureteral bypass device placement in 24 cats: a retrospective study (2016-2019). J Feline Med Surg. 2021 Aug;23(8):759-769.
- Wuillemin F, et al. Subcutaneous ureteral bypass device placement in 81 cats with benign ureteral obstruction (2013-2018). J Vet Intern Med. 2021 Nov;35(6):2778-2786.
> Dysplasie génito-urinaire chez le chien et le chat : série de cas
Introduction
La dysplasie génito-urinaire est une affection très rare décrite uniquement chez le chat. Ce terme regroupe plusieurs anomalies anatomiques congénitales à l'origine d'un rapport anormal entre les voies urinaires et génitales chez la femelle (aplasie vaginale, altération des insertions des cornes utérines...) [1-3]. L'objectif de cette série de cas est de décrire les caractéristiques cliniques et paracliniques conduisant au diagnostic d'une dysplasie génito-urinaire et la prise en charge proposée.
Matériels et méthodes
Les chiens et chats diagnostiqués avec une dysplasie génito-urinaire entre 2010 et 2022 ont été inclus de manière rétrospective. Le signalement, la présentation clinique, les résultats d'imagerie et endoscopiques, ainsi que les traitements ont été recensés. Les données continues ont été présentées sous forme de médiane (intervalle interquartile).
Résultats
Huit chattes (Européen (n=6), Siamois (n=1), Main Coon (n=1)) et 2 chiennes (Husky Sibérien, Teckel à poils longs) ont été inclues. L'âge médian au moment du diagnostic était de 1,75 ans (1,0-2,0). Six chattes sur 8 et les deux chiennes étaient stérilisées. Le poids médian des chattes était de 4,7 kg (3,9-4,7). Les signes cliniques au moment de la présentation évoluaient depuis 9,6 mois en médiane (3-15). Six chattes et les deux chiennes présentaient une incontinence par défaut de stockage. Des cystites bactériennes récurrentes ont été recensées avant le diagnostic (n=6) et des infections urinaires étaient présentes au moment du diagnostic (n=8). Le diagnostic s'est basé sur des caractéristiques échographiques et endoscopiques combinées à une vagino-urétrocystographie, à l'exception de 2 chats (uniquement par endoscopie). Les anomalies génitales étaient une aplasie vaginale (n=6), des insertions anormales des cornes utérines chez 5 chattes (insertion dans l'urètre (n=2) ou fusionnées à la paroi dorsale de la vessie (n=3)), une insertion du vagin dans l'urètre (n=2), une fistule vésico-utérine (n=1). Les anomalies urinaires étaient l'absence de méat urétral externe (n=5), l'hypoplasie du col vésical (n=2), un urètre large et court (n=5). Les papilles urétérales étaient orthotopiques, à l'exception des 2 chiennes chez qui un uretère ectopique unilatéral avait été diagnostiqué et traité chirurgicalement au préalable. Le bilan urodynamique a permis de diagnostiquer une incompétence sphinctérienne chez 2 chattes et une instabilité vésicale (n=1). Trois chattes ont été traitées chirurgicalement (sphincter hydraulique artificiel (n=2), plastie urétro-vésicale et hystérectomie) et une chienne a subi une hystérectomie avec ostéotomie pelvienne caudale ayant permis une bonne amélioration clinique. Les autres cas ont été traités médicalement (phénylpropanolamine, antibiotiques) avec une amélioration clinique plus modérée.
Discussion
Les chiens et les chats atteints de dysplasie génito-urinaire présentent généralement des infections du tractus urinaire récurrentes et une incontinence urinaire, bien que les mécanismes de l'incontinence restent encore à préciser pour certains d'entre eux [1-3]. Toutefois, une incompétence sphinctérienne est établie pour deux cas. Pour la première fois, nous rapportons deux cas de dysplasie uro-génitale chez la chienne, elles présentaient par ailleurs une association avec un uretère ectopique unilatéral. L'étiologie et les facteurs prédisposants à l'apparition d'une dysplasie génito-urinaire sont inconnus à ce jour, néanmoins chez l'homme, une étude récente soulève la possibilité que le diabète maternel puisse être un facteur contribuant à l'apparition d'anomalies congénitales génito-urinaires [4].
Conclusion
Cette série de cas met en lumière une affection encore méconnue et peu décrite chez le chat, et en constitue la première description chez le chien. Le diagnostic est souvent obtenu à l'aide d'une combinaison d'examens complémentaires, permettant d'identifier les anomalies anatomiques et fonctionnelles. L'endoscopie est un élément clé du diagnostic ; le clinicien doit être particulièrement attentif face à une aplasie vaginale. Chez un animal jeune présenté pour cystites récurrentes et/ou incontinence urinaire, une dysplasie génito-urinaire doit être envisagée.
Bibliographie
- Baines SJ, Speakman AJ, Williams JM, Cheeseman MT. Genitourinary dysplasia in a cat. Journal of Small Animal Practice. 1999;40(6):286-90.
- Fournet A, Maurey C, Decambron A, Viateau V, Manassero M. Treatment of urinary incontinence in a cat with genitourinary dysplasia using an urethral sphincter occluder. Journal of Small Animal Practice. mai 2021;62(5):391-6.
- Holt PE. Surgical Management of Congenital Urethral Sphincter Mechanism Incompetence in Eight Female Cats and a Bitch. Vol. 22, Veterinary Surgery. 1993 p. 98-9.
- Parimi M, Nitsch D. A Systematic Review and Meta-Analysis of Diabetes During Pregnancy and Congenital Genitourinary Abnormalities. Kidney International Reports. mai 2020;5(5):678-93.
> Le phénotype “myocardiopathie hypertrophique” n'est pas le seul phénotype échocardiographique associé avec l'hyperthyroïdie féline : étude rétrospective chez 115 chats (2005-2023)
Introduction
L'hyperthyroïdie est l'endocrinopathie la plus fréquente du chat âgé. Elle peut être associée à certaines anomalies cardiaques, pouvant conduire à une insuffisance cardiaque congestive. Une étude a mis en évidence que l'augmentation de l'épaisseur télédiastolique du septum interventriculaire (SIVd) et/ou de la paroi libre du ventricule gauche (PLVGd), définissant le phénotype « myocardiopathie hypertrophique » (PMCH), était fréquente chez les chats hyperthyroïdiens.[1] Outre le PMCH, le phénotype « myocardiopathie restrictive » (PMCR) a été suggéré comme étant associé à l'hyperthyroïdie féline par le groupe consensus de l'American College of Veterinary Internal Medicine (ACVIM) sur les myocardiopathies félines.[2] Cependant, à la connaissance des auteurs, aucune étude n'a à ce jour investigué cette hypothèse. Les objectifs de cette étude rétrospective étaient donc :
- de décrire les caractéristiques épidémiologiques, cliniques et échocardiographiques, ainsi que les phénotypes de myocardiopathie (PMC) associés avec l'hyperthyroïdie féline,
- de comparer les paramètres échocardiographiques des chats hyperthyroïdiens présentant un PMCH avec ceux d'une population de chats non hyperthyroïdiens contemporains atteints de MCH primitive, appariés sur l'âge et le poids, et
- d'étudier l'évolution au cours du temps des PMC associés à l'hyperthyroïdie féline après la mise en place d'un traitement antithyroïdien.
Matériels et méthodes
Les chats étaient inclus rétrospectivement dans l'étude si le diagnostic de l'hyperthyroïdie (dosage de thyroxinémie totale ou libre (T4) dépassant l'intervalle de référence du laboratoire) était établi moins de 3 mois avant ou après l'examen écho-Doppler initial, entre 2005 et 2023. Les différents phénotypes étaient définis selon les recommandations du consensus de l'ACVIM.[2,3,4,5] Le groupe de chats atteints de MCH primitive était constitué de chats âgés de 9 ans ou plus, pesant moins de 6 kg, contemporains aux chats hyperthyroïdiens sur la période étudiée. Les chats de l'étude avec un deuxième examen échocardiographique disponible et réalisé plus de 3 mois après l'initiation du traitement et plus de 3 mois après la première échocardiographie étaient inclus dans le groupe suivi. Les résultats sont présentés sous forme de médiane [écart interquartile].
Résultats
Parmi les 197 chats hyperthyroïdiens évalués pendant la période d'étude, 115 furent finalement inclus pour l'analyse statistique (âge au diagnostic=14,2 ans [12,5-15,8]; poids=3,8 kg [3,00-3,75]; T4=97,2 nmol/L [71,3-136]). Parmi ces 115 chats, 89 avaient un PMC (77%), répartis comme suit : 74 PMCH (83%), 13 PMCR (15%) et 2 (2%) phénotypes « myocardiopathie non spécifique » (PMCNS). Parmi les 74 chats avec un PMCH, 38/74 (51%) présentaient une hypertrophie diffuse (dont 34 avec une hypertrophie symétrique (0,7SIVd/PLVGd1,3) et 4 avec une hypertrophie asymétrique) et 36/74 (49%) une hypertrophie segmentaire. Le groupe de chats atteints de MCH primitive était constitué de 116 chats (âge=12,0 ans [10,4-14,0]; poids=4,5 kg [3,8-5,0]; T4=24,0 nmol/L [18,2-33,3]). Le diamètre télédiastolique du ventricule gauche (VGd) était plus grand chez les chats hyperthyroïdiens avec un PMCH (14,7 mm [13,3-16,3], n=74) que les chats atteints de MCH primitive (13,1 mm [11,7-15,0], n=86 ; p 0,01). De plus, une hypertrophie focale du septum interventriculaire en région sous-aortique (SIV-SA) était significativement plus fréquente (p0,01), et l'épaisseur télédiastolique du SIV-SA (SIV-SAd) était significativement plus importante (p0,01) chez les chats atteints de MCH primitive (86/97=89%; SIV-SAd=6,9 mm [6,2-7,7]) que chez les chats hyperthyroïdiens avec un PMCH (34/67=51%; SIV-SAd=5,7 mm [5,0-6,9]). Dix-neuf chats furent finalement inclus dans le groupe suivi. La T4 était significativement plus élevée à l'inclusion (108 nmol/L [75,8-159]) que lors du suivi (27,3 nmol/L [22,7-44,2]; p 0,01). Seize chats (84%) présentaient un PMC à l'inclusion (PMCH = 13 ; PMCR = 3). Sept des 13 chats avec un PMCH (54%) et 2/3 chats avec un PMCR ont montré une résolution complète du PMC lors du suivi. Un chat avec un PMCH à l'inclusion, non stabilisé médicalement malgré une augmentation importante et progressive du traitement antithyroïdien, a développé un PMCNS. IV.
Discussion - Conclusion
Cette étude confirme qu'un grand nombre de chats hyperthyroïdiens présente un PMC, avec une majorité de PMCH (83%) mais également des PMCR (15%) et PMCNS (2%). Les résultats suggèrent que les chats hyperthyroïdiens avec un PMCH ont un VGd plus grand et une hypertrophie moins fréquente et moindre du SIV-SA que les chats atteints de MCH primitive. Enfin, l'amélioration substantielle des anomalies échocardiographiques chez les chats atteints de PMCR au cours du temps (avec normalisation complète du phénotype chez 2/3 chats) suggère que le PMCR pourrait être une conséquence de l'hyperthyroïdie, et pourrait être réversible après mise en place d'un traitement antithyroïdien.
Références
- Weichselbaum et al, Vet Radiol Ultrasound, 2005
- Luis Fuentes et al, J Vet Intern Med, 2020
- Chetboul et al, J Vet Intern Med, 2019
- Karp et al, J Vet Cardiol, 2022
- Fox et al, Circulation, 2000
> Présentation atypique d'un hypoadrénocorticisme félin
Introduction
L'hypoadrénocorticisme (ou maladie d'Addison) est rarement documenté chez le chat. Cette description originale illustre la démarche diagnostique menée chez un chat présenté pour des troubles nerveux centraux. La prise en charge thérapeutique des félins reste peu décrite, et les spécificités liées à l'espèce féline seront abordées dans ce cas clinique.
Anamnèse
Une chatte stérilisée British shorthair de 4 ans était présentée pour troubles locomoteurs et apathie évoluant depuis environ deux semaines. Les propriétaires rapportaient une ataxie, plus marquée au niveau des membres pelviens.
Examen clinique
L'examen clinique général mettait en évidence une hypothermie à 36,8°C, et une hypovigilance légère associée à un déficit des réactions posturales du bipède postérieur. Le reste de l'examen neurologique était peu remarquable.
Démarche diagnostique
Un bilan sanguin, incluant un hémogramme, un panel biochimique, un ionogramme et une mesure de la calcémie ionisée, était normal, à l'exception d'une hyponatrémie à 124 mmol/L (150-165), une hypochlorémie à 91 mmol/L (112-129), et une hyperkaliémie à 8,4 mmol/L (3,5-5,8). Une analyse d'urine révélait une densité à 1.042. À ce stade, les hypothèses retenues étaient un hypoadrénocorticisme, une sécrétion inappropriée d'hormone anti-diurétique ou la présence d'une polydipsie psychogène. Les troubles neurologiques étaient supposés secondaires à l'hyponatrémie sévère. À l'échographie, la taille des glandes surrénales était dans les valeurs usuelles (VU). Une résonance magnétique n'a pas montré d'anomalie significative, y compris au niveau de l'hypophyse.
Un test de stimulation à l'ACTH fût réalisé par injection intramusculaire de 125 ug de tétracosactide (Synacthène®) avec mesure de la cortisolémie et de l'aldostéronémie à T0, après 30 (T30) et 60 minutes (T60). Les valeurs suivantes ont été obtenues : Cortisolémie : T0 : 13,4 nmol/L, T30 : 15,9 nmol/L,T60 : 12,6 nmol/L ; Aldostéronémie : T0 : 62 pmol/L (44-239), T30 : 59 pmol/L (44-239), T60 : 75 pmol/L (44-239). Ce test a confirmé la présence d'un hypocorticisme. Les valeurs d'aldostérone étant basses, bien que dans les VU pour l'espèce, l'absence de stimulation face au tétracosactide, combinée aux désordres électrolytiques décrits, plaidait en faveur d'une déficience en minéralocorticoïdes.
Traitement
L'animal a été hospitalisé sous fluidothérapie adaptée aux besoins hydroélectrolytiques afin de corriger l'hyponatrémie graduellement. Malgré cela, la natrémie est restée nettement inférieure aux VU. Une amélioration clinique et neurologique a cependant permis d'envisager une sortie d'hospitalisation sept jours après l'admission. Une glucocorticothérapie avait été initiée à raison de 0,5 mg/kg de prednisolone par jour. Une injection sous cutanée de désoxycorticostérone pyvalate (DOCP, Zycortal®) à 2,2 mg/kg a été administrée au moment de la sortie d'hospitalisation. Dix jours plus tard, les désordres électrolytiques étaient résolus avec une natrémie dans les VU pour la première fois depuis la présentation, et le chat avait retrouvé un état de conscience normal et une complète résolution des signes cliniques initiaux.
Discussion
Ce cas est particulièrement intéressant de par sa présentation clinique atypique et la démarche diagnostique à mener malgré la faible prévalence de cette maladie dans l'espèce féline. Il illustre la nécessité de ne pas éliminer cette endocrinopathie sur la base de la mesure des glandes surrénales ou des valeurs d'aldostérone mesurées [1]. Les valeurs d'aldostérone chez ce patient ne sont pas inférieures aux VU et ne permettent donc pas un diagnostic d'hypoadrénocorticisme au sens strict. Cependant les valeurs de référence sont mal définies chez le chat et l'absence de stimulation de l'aldostérone associée à la réponse clinique claire sont en faveur d'une déficience en minéralocorticoïdes. Un suivi attentif et régulier du ionogramme de ce patient au cours des semaines suivant l'injection va permettre de confirmer le diagnostic en documentant une récidive de l'hyponatrémie et de connaître l'intervalle entre deux administrations de DOCP ainsi que la dose à administrer [2]. Bien que le dosage de l'ACTH endogène permette de distinguer un hypocorticisme primaire d'un secondaire [3], son interprétation restant délicate dans l'espèce féline, il n'a pas été jugé opportun de le réaliser chez ce patient.
Conclusion
L'hypoadrénocorticisme félin est une maladie rare et peu documentée [4], qui doit néanmoins être considérée en présence de désordres électrolytiques caractéristiques. L'absence de données exhaustives dans la littérature rend le traitement de ces chats arbitraire. L'ensemble des publications précitées souligne la nécessité d'administrer des doses de glucocorticoïdes et de minéralocorticoïdes plus importantes que dans l'espèce canine, avec une fréquence d'administration moindre. Toutefois ces prises de décisions doivent s'appuyer sur des contrôles cliniques et biologiques rapprochés.
Bibliographie
- Sieber & al Clinical features and long-term management of cats with primary hypoadrenocorticism using desoxycorticosterone pivalate and prednisolone JVIM 2023
- Woolcock & al Successful treatment of a cat with primary hypoadrenocorticism and severe hyponatremia with desoxycorticosterone pivalate (DOCP). Can Vet J.2015
- Ettinger & al Textbook of veterinary internal medicine. 8th ed 2017
- Gunn-Moore D.Feline endocrinopathies. Vet Clin North Am Small Anim Pract.2005
> Un cas de flutter diaphragmatique synchrone idiopathique chez un Jack Russell mâle entier de 2 ans.
Introduction
Le flutter diaphragmatique synchrone (SDF) est une affection peu commune caractérisée par des contractions involontaires du diaphragme qui entraînent des mouvements synchronisés de la paroi abdominale en rythme avec les battements du coeur. Ce phénomène est supposé être causé par des dépolarisations aberrantes dans les nerfs phréniques causées par l'activité électrique du coeur, les nerfs phréniques étant anatomiquement proches du coeur sur leur trajet vers le diaphragme.
Certaines situations métaboliques spécifiques, telles que l'hypocalcémie, peuvent augmenter l'irritabilité des nerfs phréniques et conduire à un SDF, mais cette affection peut également être idiopathique, comme le montre notre cas clinique.
Anamnèse et commémoratifs
Un Jack Russell Terrier mâle castré âgé de 2 ans a été présenté en consultation de médecine interne à VetAgro Sup pour des contractions persistantes et involontaires de la paroi du flanc abdominal gauche.
Ces anomalies ont été observées pour la première fois lorsque le chien avait 4 mois et était associée à une gêne subjective et de l'agitation. Au cours des 6 mois suivants, une aggravation de la fréquence et de la gêne occasionnée ont été observées. Aucun autre signe clinique (respiratoire, intolérance à l'exercice en particulier) n'a été rapporté.
Un an auparavant, le chien avait été présenté chez le vétérinaire référent, qui avait effectué un hémogramme, une biochimie standard et une échographie abdominale ne révélant pas d'anomalie.
Examen clinique
L'examen clinique à distance a révélé un chien vif et alerte présentant des contractions involontaires de la paroi abdominale bilatérale principalement localisées dans le cercle de l'hypochondre. Ces contractions étaient synchrones avec le choc précordial. Les constantes vitales étaient dans les valeurs usuelles.
L'auscultation cardiaque permettait d'identifier des bruits cardiaques avec une intensité anormalement élevée, audible dans l'ensemble de la cavité thoracique et dans la région abdominale crâniale. Par ailleurs, un souffle systolique basal gauche de grade 3/6 était également ausculté. L'examen clinique permettait de suspecter un SDF.
Un examen en amplification de luminance du thorax a été réalisé afin de visualiser la synchronisation entre les contractions diaphragmatiques et myocardiques et confirmer le diagnostic. Des radiographies thoraciques n'ont pas permis de mettre en évidence d'anomalie thoracique par ailleurs. Afin d'explorer une éventuelle cardiopathie, un examen échocardiographique a été réalisé et a montré une accélération du flux aortique et une régurgitation tricuspidienne modérée. Parallèlement, un examen électrocardiographique n'a pas montré d'anomalie.
Enfin, comme le SDF peut être secondaire à des désordres hydroélectrolytiques, un ionogramme complet a été réalisé et n'a pas permis d'identifier d'anomalie.
Compte-tenu de l'absence de traitement satisfaisant dans le contexte d'un SDF idiopathique, aucun traitement n'a été instauré.
Suivi
Un an plus tard, le chien présente toujours les mêmes anomalies cliniques de manière inchangée et est en très bon état général.
Discussion
Le cas rapporté décrit un SDF idiopathique. Il s'agit d'une affection rare et méconnue chez le chien, pouvant conduire à un diagnostic potentiellement erroné.
Les signes cliniques étant peu communs et impressionnants, une maladie cardiaque majeure peut être suspectée, d'autant que les mouvements du diaphragme peuvent mimer ou exacerber des anomalies auscultatoires.
De rares cas de SDF sont rapportés dans la littérature chez le chien. Dans la plupart des cas, une cause sous-jacente ou un déclencheur est identifié (hypocalcémie, troubles gastro-intestinaux marqués, néphropathies, traumatisme) et le SDF se résout avec la gestion de l'anomalie primitive. Chez le cheval, le SDF est un phénomène mieux documenté survenant majoritairement chez les chevaux d'endurance. Il est supposé que celui-ci survient secondairement à l'hypocalcémie, l'hypokaliémie et l'alcalose métabolique engendrés par l'effort et cesse avec le repos, voire l'administration intraveineuse de calcium.
Conclusion
Le SDF est une affection rare et méconnue chez le chien. Son diagnostic repose sur l'observation de contractions diaphragmatiques synchrones avec les battements du coeur à travers l'examen clinique et un examen en amplification de luminance. Des désordres hydroélectrolytiques ou acido-basiques doivent être recherchés mais cette affection peut s'avérer idiopathique. Aucun traitement efficace n'est actuellement connu en médecine vétérinaire et humaine.
Références
- Detweiler DK. Contraction of the diaphragm synchronous with the heartbeat in dogs. J Am Vet Med Assoc 1955;126:445-448.
- Vrabelova D, Gilor C, Habing A, Schober KE, Johnson S. Synchronous Diaphragmatic Flutter Secondary to Primary Hypoparathyroidism in a Dog. J Am Anim Hosp Assoc. 2015 Nov-Dec;51(6):392-5.
- Foreman JH. The exhausted horse syndrome. Vet Clin North Am Equine Pract. 1998 Apr;14(1):205-19.
