> Cardiologie du jeune : apport de la génétique en cardiologie
Tony GLAUS
Division de Cardiologie,
Faculté Vetsuisse, Université de Zurich
I- Introduction
Les maladies cardiaques sont souvent divisées en congénitales et acquises.
Congénital est souvent assimilé à génétique, mais un défaut cardiaque peut en principe apparaître au cours de l'embryogenèse sous l'influence d'un facteur extérieur, par exemple une médication administrée à la mère. En cas de doute, une malformation cardiaque congénitale est considérée comme génétique. Par ailleurs, il faut savoir que la sténose sous-aortique (SAS) du chien figure parmi les malformations cardiaques congénitales, même si elle n'est pas encore présente à la naissance et se forme au cours des premières semaines de vie. Néanmoins, il n'y a pas de problème à désigner la SAS comme une malformation cardiaque congénitale.
Acquise implique qu'une maladie cardiaque se développe au cours de la vie sous l'influence d'un facteur extérieur. Mais le fait est que pratiquement toutes les maladies (cardiaques et non-cardiaque) ont une base génétique. C'est également important d'un point de vue pratique et pragmatique, car les assurances assurent volontiers les animaux, mais lorsqu'il s'agit de payer les frais de vétérinaire après des années, il peut être écrit en petits caractères que les maladies génétiques ne sont pas prises en charge.
D'un point de vue zootechnique, il est important de noter que non seulement les maladies dites congénitales, mais aussi de nombreuses maladies acquises ont très souvent une base génétique. Pour certaines maladies cardiaques en médecine humaine, en particulier pour les cardiomyopathies, la classification définit un groupe de "cardiomyopathies mixtes", dans lequel la cardiomyopathie dilatée (DCM) est notamment classée. Mixte signifie ici qu'il existe une base génétique et qu'une influence extérieure (le plus souvent une myocardite virale) entraîne l'apparition d'une DCM chez un individu génétiquement prédisposé.
II- Principales anomalies cardiaques congénitales
1. Chez le chien
Dans ce contexte, les principales anomalies cardiaques congénitales chez le chien sont la sténose de la valve pulmonaire, la sténose fibromusculaire sous-aortique, la persistance du canal artériel de Botalli et le défaut du septum interventriculaire. La dysplasie tricuspide est nettement plus rare. Ces 5 maladies représentent environ 85% de toutes les malformations cardiaques congénitales du chien. Les autres maladies sont le défaut du septum auriculaire, la tétralogie de Fallot, les combinaisons de malformations cardiaques, les malformations cardiaques cyanogènes, les arythmies (en particulier la tachycardie supraventriculaire due à l'accessory pathway avec atrioventricular reciprocating tachycardia, AVRC) et très rarement le cor triatriatum droit ou gauche. (La liste n'est pas exhaustive)
La fréquence des malformations cardiaques congénitales est totalement différente chez les chats. La plus fréquente est certainement le défaut du septum ventriculaire. Dans la littérature, les dysplasies des valves auriculo-ventriculaires sont décrites comme fréquentes ; cependant, nous ne voyons pratiquement jamais de dysplasies AV hémodynamiquement significatives. Les sténoses et le Botalli sont rares. En fait, nous voyons presque plus souvent un cor triatriatum gauche que des sténoses ou des dysplasies chez les chats.
Les principales maladies cardiaques acquises chez le chien sont la dégénérescence de la valve mitrale, la cardiomyopathie dilatée (CMD), l'épanchement péricardique d'origines diverses (en particulier les tumeurs) et les tumeurs dans ou sur le cœur sans épanchement péricardique. Nous voyons occasionnellement une cardiomyopathie arythmogène du ventricule droit (ARVC), généralement chez le boxer, très rarement une endocardite valvulaire, principalement sur la valve mitrale ou aortique, très rarement une myocardite (avec des arythmies ou avec un phénotype CMD) et pratiquement jamais une cardiomyopathie hypertrophique (CMH). En règle générale, les maladies "acquises" apparaissent au plus tôt en milieu de vie. Si une maladie présentant un tel phénotype apparaît chez un jeune animal (en fait aussi chez un animal plus âgé), il faut toujours penser en premier lieu à une maladie congénitale pour établir un diagnostic différentiel, par exemple à une Botalli en cas de phénotype CMD. Ces maladies acquises sont en fait très fortement prédéterminées génétiquement, c'est notamment le cas de la DCM du Doberman Pinscher, de la cardiomyopathie arythmogène du Boxer, mais aussi de la dégénérescence de la valve mitrale (et pas uniquement chez le Cavalier King Charles Spaniel).
Finalement, les vers du cœur, Dirofilaria immitis et Angiostrongylus vasorum, sont aujourd'hui très importants, bien que chez ces animaux, il ne s'agisse pas en premier lieu d'une maladie cardiaque mais d'une maladie vasculaire pulmonaire et que la maladie cardiaque (cor pulmonale) soit la conséquence d'une hypertension pulmonaire.
2. Chez le chat
La principale cardiopathie acquise chez le chat est la cardiomyopathie hypertrophique. La CMD est devenue très rare; la cardiomyopathie restrictive est rare mais souvent surdiagnostiquée (il s'agit généralement d'une CMH); une ARVC est parfois observée. Les tumeurs cardiaques (avec ou sans épanchement péricardique) ne sont pas non plus rares chez le chat. Les maladies systémiques qui endommagent secondairement le cœur (en plus) sont alors importantes, en particulier l'hyperthyroïdie et l'hypertension systémique.
Ce qui est très important chez le chat, c'est ce qu'on appelle "transient myocardial thickening" (TMT) ; les chats concernés se présentent comme une CMH décompensée avec un œdème pulmonaire. Mais contrairement à la CMH, l'hypertrophie ventriculaire gauche échographique est complètement réversible. Alors que nous pensions auparavant que la cause était une myocardite infectieuse aiguë, nous pensons aujourd'hui qu'il s'agit plutôt d'une sorte de cardiomyopathie de stress. Au stade aigu, il est souvent difficile de distinguer une TMT d'une CMH dans un cas particulier. Seule l'évolution permet de faire la distinction définitive; une CMH n'est pas réversible.
III- Tests génétiques
Les tests génétiques connus chez le chien sont la mutation dans le gène PDK4 pour la DCM du Doberman Pinscher, la mutation dans le gène TTN pour le Boxer et la mutation dans le gène FBN1 pour la sténose pulmonaire du Cocker. Chez le Maine Coon et le Ragdoll, une mutation dans le gène MYBPC3 est considérée comme la cause de la CMH. Alors que plus de 1000 mutations sont connues chez l'homme pour la CMH, on peut se demander dans quelle mesure la connaissance de cette mutation féline est vraiment utile, car tous les chats concernés ne développent pas une CMH cliniquement manifeste et de très nombreux chats présentant une CMH cliniquement manifeste sont négatifs à ce test génétique.
> Démarche face à un souffle cardiaque chez le jeune
Lausanne & Velizy (78) Suisse
I- L'auscultation
L’auscultation cardiaque chez le chiot (jusqu’à 6 mois-1 an) et le chaton (jusqu’à 6 mois) est primordiale et la première consultation vaccinale doit représenter l'opportunité de détecter au plus tôt de possibles anomalies cardiaques qui sont presque toujours congénitales.
La plupart des patients de cet âge ayant une auscultation normale, un protocole standardisé permet de rendre frappantes les anomalies auscultatoires. Il faut pratiquer sur le plus de patients possible en rapportant systématiquement ce que l’on entend aux définitions des souffles. Il faut prendre son temps et surtout se faire confiance. Les maladies cardiaques du jeune patient sont plus variées que chez le patient adulte, ceci ayant pour conséquence des anomalies auscultatoires plus variées. On veillera à bien évaluer les points suivants :
- Intensité du souffle
- 1/6 : focal. À peine audible. Calme environnant.
- 2/6 : focal. Sûr de l’entendre. Léger.
- 3/6 : évident. Plutôt fort. Irradie plusieurs régions.
- 4/6 : très fort. Pas de frémissement palpable (thrill).
- 5/6 : très fort. Frémissement palpable.
- 6/6 : très fort. Frémissement palpable. Je l’entends même avec mon stéthoscope décollé de 1 cm de la peau.
- Phase du cycle cardiaque : systolique, continu, diastolique (rare)
- Durée du souffle : court, long
- Autres anomalies à l’auscultation : bruit de galop, arythmie…
Aire d’auscultation : focal, diffus (Fig. 1), image inspirée de [1]
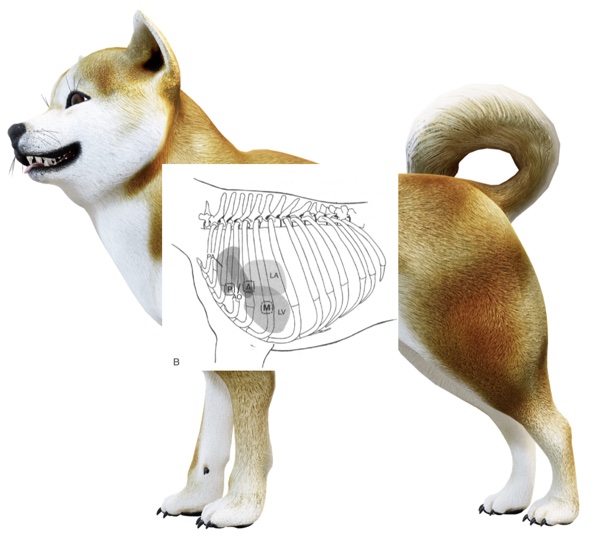
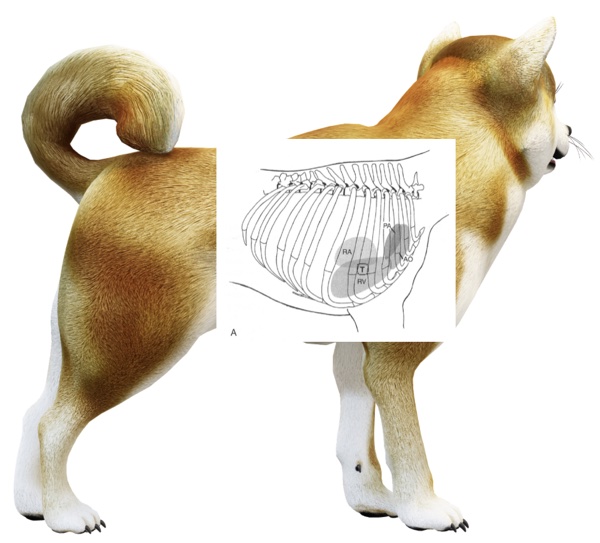
Figure 1
II- Les souffles
Les souffles peuvent être pathologiques (associés à une anomalie structurelle cardiaque) ou non.[2] Parmi les souffles non-pathologiques, certains sont dits fonctionnels (cause physiologique comme l’anémie) et d’autres innocents (aucune cause structurelle ou physiologique). Les souffles non-pathologiques sont fréquents chez les chiots et chatons et leur identification est clé. Une anémie est à exclure, surtout chez les chatons qui peuvent présenter un hématocrite bas. L’excitation chez le chat peut aussi entraîner un souffle.
Ce qu’il faut retenir des souffles non-pathologiques du chiot, c’est qu’ils sont souvent d’intensité 1 à 2 sur 6, courts, systoliques, ne masquent pas les bruits cardiaques normaux et sont surtout audibles en position basale gauche.[2] Dans ce cas, il est sage de proposer aux propriétaires une nouvelle auscultation du souffle 3 mois plus tard.
Les maladies cardiaques les plus courantes du chiot sont la sténose pulmonaire et sous-aortique, la persistance du canal artériel et les communications interventriculaires dans une moindre mesure. Les souffles cardiaques d’intensité supérieure à 3 doivent être investigués davantage, tout comme ceux qui diffèrent des caractéristiques usuelles des souffles non-pathologiques décrits plus haut (même d’intensité inférieure à 3). Une échocardiographie effectuée par un(e) cardiologue est dans ce cas recommandée.
Les outils permettant de distinguer les souffles pathologiques/non-pathologiques chez le chaton sont moins fiables. Par exemple, les communications interventriculaires sont les maladies cardiaques congénitales les plus fréquentes chez cette espèce et l’intensité du souffle est généralement inversement corrélée à sa sévérité.
Quand un souffle pathologique est suspecté, il est indispensable de proposer une échocardiographie afin de caractériser la maladie cardiaque. Dans de nombreux cas, un traitement peut être proposé. Pour une part non négligeable de maladies cardiaques congénitales, un traitement curatif est disponible, notamment par voie interventionnelle, voire chirurgicale. Dans le cas contraire, certains propriétaires seront reconnaissants de savoir rapidement que pour d’autres maladies, aucun traitement n’existe ou avec des résultats mitigés.
Bibliographie
- Sisson DD, Ettinger SJ. The Physical Examination. In : Fox PR, ed, Textbook of Canine and Feline Cardiology. Second ed. Philadelphia : Saunders Co ; 1999 : 46-64
- Côté E et coll. Management of incidentally detected heart murmurs in dogs and cats. J Amer Vet Med Assoc. 2015 ; 246 (10) : 1076-88.
> La décompensation cardiaque chez le jeune animal : les immanquables / à quoi penser ?
Tony GLAUS
Division de Cardiologie,
Faculté Vetsuisse, Université de Zurich
D'un point de vue clinique pratique, une décompensation cardiaque peut être différenciée en “défaillance en amont” et “défaillance en aval”. Bien que le débit d'aval et le débit d'amont soient compromis dans toutes les maladies, l'une ou l'autre de ces manifestations peut dominer.
Les maladies avec surcharge de pression (sténoses sous-aortiques et pulmonaires, hypertension pulmonaire en cas de reverse PDA et VSD) présentent en premier lieu des signes d'insuffisance en amont, c'est-à-dire une baisse des performances et des syncopes, et seulement exceptionnellement, une insuffisance en aval (surtout de l'ascite, mais il est intéressant de noter que même dans la sténose sous-aortique, l'ascite est plus fréquente que l'œdème pulmonaire). En revanche, dans le cas des shunts gauche-droite (PDA, VSD, ASD), ce n'est plutôt pas l'insuffisance de performance qui domine, mais plutôt l'insuffisance à rebours (œdème pulmonaire en cas de PDA, ascite en cas de grand ASD).
Une décompensation en aval est généralement objectivée radiologiquement, théoriquement aussi par échographie pulmonaire (B-lines), mais il faut garder à l'esprit que les B-lines ne reflètent qu'une pathologie pulmonaire interstitielle et que les pathologies pulmonaires interstitielles d'origine non cardiogène produisent donc aussi des B-lines (exemple important : A. vasorum, qui peut déjà entraîner une dyspnée de haut niveau chez de très jeunes animaux). Les radiographies thoraciques ne permettent pas seulement de constater une opacification pulmonaire, mais aussi de caractériser la localisation de l'opacification, ainsi que d'évaluer la taille du cœur et la vascularisation pulmonaire. En bref, les radiographies permettent de confirmer la suspicion de décompensation cardiaque et de réfléchir au diagnostic différentiel. Il est inutile de traiter un chien par l'utilisation massive de diurétiques si le cœur n'est pas le problème.
"Décompensation cardiaque" ou "insuffisance cardiaque" ne sont pas des diagnostics. Si on est persuadé qu’une maladie cardiaque est la cause de la présentation clinique, il faut donner un nom spécifique à cette maladie. Donc, après avoir corroboré avec des radiographies que la dyspnée est due à une congestion cardiogénique, if faut confirmer le diagnostic par échographie et identifier la maladie concrète / spécifique. Je constate que de nombreux œdèmes pulmonaires cardiogéniques sont diagnostiqués alors que je ne peux pas les voir sur la radiographie et que l'échographie exclut pratiquement toute décompensation cardiaque (donc ventriculaire gauche). Tandis que la mise au repos et l'administration d'oxygène et de butorphanol ne sont jamais des erreurs dans le traitement aigu, les diurétiques ne sont indiqués qu'en cas d’œdème cardiogénique. L'indication importante d'un examen échographique, pour moi, est effectivement d'apporter la preuve qu'aucune maladie cardiaque primitive n'est à l'origine de la présentation clinique aiguë.
Une décompensation cardiogénique est beaucoup plus difficile à interpréter chez le chat que chez le chien au moyen de radiographies. Ce qui aide en pratique dans une situation aiguë, c'est le fait que chez un chat présentant une dyspnée importante, si elle n'est pas la conséquence d'une obstruction des voies respiratoires supérieures (il doit obligatoirement y avoir un stridor bruyant) ou d'un épanchement pleural (bruits respiratoires faibles malgré la dyspnée et bruits cardiaques sourds), elle est pratiquement toujours d'origine cardiaque. De mon point de vue, il est donc légitime de traiter un chat dyspnéique en urgence avec de fortes doses de diurétiques (et oxygène et butorphanol). Mais même chez le chat, il faut ensuite confirmer par échographie une cause cardiogénique.
Lorsqu'une échographie est réalisée chez un jeune animal suspect de décompensation cardiogénique, le plus important est de réaliser une évaluation propre et qualitative du cœur en 2 dimensions à partir d'une vue 4 cavités droite-latérale. Cette seule évaluation permet d'obtenir 90% des informations nécessaires : s'agit-il d'une surcharge volumique ou d'une surcharge de pression ? Le problème se situe-t-il à gauche ou à droite ? Un atrium est-il dilaté ? Les veines pulmonaires sont-elles congestionnées (plus tard, aussi évaluation de la veine cave caudale et les veines hépatiques), ou s'agit-il réellement d'une hypovolémie à gauche ou à droite ? Quelle est la fonction systolique du ventricule gauche ? Comment se présentent les valves (évaluation de la valve pulmonaire dans le short axis) ?
En cas de surcharge volumique gauche chez le chien, ou de phénotype dit CMD, le diagnostic de suspicion principal est un Botalli, dans le diagnostic différentiel plausible mais rare une CMD causée par une tachycardie (atrioventricular reciprocating tachycardia, Wolf Parkinson White), très théoriquement une myocardite, très rarement une fibroélastose endocardique (non curable, diagnostic pathologique). En cas de "poumon blanc", mais de ventricule gauche vide avec un ventricule droit proéminent, un "poumon blanc cardiogénique", donc un œdème pulmonaire cardiogénique, est exclu ; dans ce cas, la pathologie pulmonaire devrait être le problème primaire, par exemple le Angiostrongylus vasorum mentionné, et le furosémide n'est pas un traitement raisonnable.
Nous voyons aujourd'hui assez fréquemment chez les chats le "transient myocardial thickening" (TMT) déjà mentionné. Typiquement, une jeune chatte, auparavant apparemment en parfaite santé, est présentée 2-3 jours après une anesthésie (ovariectomie) avec une détresse respiratoire aiguë. L'écho permet de documenter un épaississement du ventricule gauche (phénotype dit de CMH). Les différences subtiles en cas de TMT par rapport à une CMH réelle peuvent être les suivantes : oreillette gauche presque normale ou du moins pas trop dilatée, choc hypotensif (nous ne le voyons plutôt pas en cas de CMH), troponine cardiaque I (cTnI) élevée. Chez ces animaux aussi, la stabilisation de la dyspnée avec de l'oxygène, du furosémide, du butorphanol est au premier plan; en cas de choc cardiogénique, nous administrons du pimobendan i.v., mais il n'existe pas de données scientifiques à ce sujet.
