> Le jeûne du jeune : jeun pré-anesthésique, hypoglycémie, réalimentation
Toulouse France
On considérera le jeune surtout de la naissance au sevrage, car, après deux mois, les caractéristiques physiologiques du chaton ou du chiot se rapprochent progressivement des caractéristiques adultes.
Ces animaux combinent tous les inconvénients pour être anesthésiés, entre autres car la mise à jeun comporte des risques importants.
En effet, le nouveau-né est très riche en eau (donc très sujet à la déshydratation), ne possède que très peu de réserves sous forme de glycogène dans le foie et sous forme de triglycérides dans son tissu adipeux. La faible quantité d’acides aminés éventuellement disponibles se traduit par une albuminémie plus faible qu’à l’âge adulte jusqu’à l’âge de 8 semaines (Center et al., 1995), albumine aussi nécessaire au transport de nombreuses molécules anesthésiques.
Aussi, le chiot ou le chaton n’a aucune réserve pour faire face au jeûne et s’il est nécessaire il devra être le plus court possible. Le jeûne préopératoire n’est donc pas nécessaire avant l’anesthésie et ne doit pas dépasser 1 à 2 heures.
Durant l’intervention, la glycémie est entretenue par l’utilisation du glycogène hépatique et par la gluconéogenèse hépatique qui restent très limitées (Cohn, 2015 ; Kliegman et al., 1983 ; Münnich et Küchenmeister, 2022). Aussi, il peut être nécessaire durant l’intervention de mesurer la glycémie en temps réel durant l’intervention à l’aide d’un glucomètre et supplémenter en glucose en évitant absolument l’hyperglycémie.
Sur un autre plan, toutes les fonctions dont les fonctions liées à la nutrition sont très dépendantes de la température corporelle : par exemple, lors de légère hypothermie, le lait ne transite plus vers l’intestin grêle et risque d’entrainer des régurgitations donc des fausses routes, et un déficit en énergie. Aussi, pendant l’intervention et après l’intervention, la température corporelle doit être conservée au maximum, par exemple avec des bouillottes.
En période post-anesthésique, si la glycémie et la température corporelle sont conservées, les fonctions d’alimentation sont conservées et l’animal peut reprendre un repas dès qu’il est capable de déglutir et se mettre en sternal. On le replace donc avec sa mère, en surveillant. Ceci ne doit pas dépasse non plus une à deux heures après anesthésie.
Chez les chiots et les chatons qui ne tètent pas, la glycémie chute rapidement, et dans tous les cas, les réserves hépatiques sont complètement épuisées dans les 24 heures (Cohn, 2015 ; Kliegman et al., 1983 ; Münnich et Küchenmeister, 2022). Cette durée peut être encore plus courte chez des très jeunes ou des malades. Un nouveau-né hypoglycémique peut pleurer, avant de présenter une faiblesse généralisée, une réduction ou une absence du réflexe de succion et une interruption de l'allaitement, aggravant la situation. Dans ce cas, il est nécessaire d’alimenter le chiot ou le chaton par sonde, en maitrisant les quantités de lait maternisé (maximum 1/10 x 250 x P, par repas), et qui doit être distribué lentement et à 38°C.
Rappelons qu’une hypoglycémie sévère entraîne une bradycardie, des convulsions, un coma et la mort (Center, 1995 ; Mueggler et al., 1981). Une glycémie < 92 mg/dL chez le nouveau-né dans les premières 24 heures de vie augmentent le risque de décès pendant la période néonatale (Mila et al., 2017).
Bibliographie
- Center SA, Hornbuckle WE, Hoskins JD. The liver and pancreas. In: Hoskins JD, ed. Veterinary Pediatrics, 2nd ed. Philadelphia, W.B. Saunders, 1995; 189
- Cohn AL, Lee JA (2015) Pediatric Critical Care. Clin Brief 35–44.
- Kliegman RM, Miettinen EL, Morton SK (1983) Hepatic and cerebral energy metabolism after neonatal canine alimentation. Pediatr Res 17, 285-291.
- Mila H, Grellet A, Delebarre M, Mariani C, Feugier A, Chastant-Maillard S (2017) Monitoring of the newborn dog and prediction of neonatal mortality. Prev Vet Med 143, 11–20.
- Mueggler PA, Black JA, Carpenter S, Koler RD, Metcalfe J (1981) Postnatal regulation of oxygen delivery: control of erythropoiesis followingbirth in dogs. Respir Physiol 43, 189-196.
- Münnich A, Küchenmeister U (2014) Causes, diagnosis and therapy of common diseases in neonatal puppies in the first days of life: Cornerstones of practical approach. Reprod Domest Anim 49, 64–74.
> Particularités anesthésiques : le jeune, un vieux comme les autres ?
Toulouse France
I- Introduction
De de la même manière que pour le patient gériatrique, les contraintes physiologiques en lien avec l’anesthésie chez le jeune sont étroitement liées à la dysfonction organique observée aux extrêmes de l’âge. Alors que chez le patient vieillissant, la réserve fonctionnelle est peu à peu limitée par la dégénérescence des organes, c’est au contraire leur immaturité qui conduit aux mêmes effets chez le nouveau-né et le très jeune patient. L’anesthésiste doit ainsi veiller à ne pas causer de dommages inutiles à des organes en développement ni accélérer leur dégénérescence.
Bien que ne faisant pas consensus absolu, on utilisera le terme nouveau-né pour des des chiots et des chatons âgés de moins de 4-6 semaines et celui de pédiatrique entre 4-6 et 12 semaines. Les craintes et enjeux liés à la réalisation d’une anesthésie générale sont ici réels, notamment du fait de l’immaturité métabolique. Ici, plus encore que dans la population générale il convient de peser lourdement la balance bénéfice risque liée à l’acte, à l’anesthésie ou surtout à l’état clinique du patient en lien avec son âge et ses comorbidités. On retiendra donc avant tout à la notion de primum non nocere puisque le recours à l’anesthésie générale dans cette population doit se limiter strictement à des interventions chirurgicales visant à corriger des anomalies congénitales menaçant à court terme la vie de l’animal ou à des actes urgents.
La procédure anesthésique ne se limitant jamais à la simple approche médicamenteuse, il convient de connaître les principales particularités physiologiques mais également anatomiques et pharmacologiques liées au patient pédiatrique afin de pouvoir anticiper les risques, établir une prise en charge, mettre en place la surveillance adaptée et prévenir les complications.
II- Particularités physiopathologiques, anatomiques et pharmacologiques et identification des risques spécifiques.
Le principal facteur de risque de mortalité anesthésique chez les carnivores domestiques reste toujours l’état clinique pré-anesthésique, approché communément par le système de stade ASA. Ici le patient est considéré comme ASA II ou III du fait du maintien très précaire de l'homéostasie très précaire. Il sera bien entendu considérablement majoré par la présence de comorbidités graves.
1. Particularités du système respiratoire
La macroglossie et une cavité oro-pharyngée de taille restreinte peuvent gêner la visualisation lors de l’intubation mais aussi obstruer les voies aériennes supérieures lors de la sédation ou du réveil à cause de la myorelaxation. Le maintien de la perméabilité des voies aériennes supérieures doit être assuré, notamment par une intubation pour les procédures invasives. Elle reste compliquée par les dimensions restreintes de la trachée et du larynx ainsi que par leur flaccidité et fragilité. La grande compliance thoracique ainsi que la prédisposition au collapsus des voies aériennes profondes les prédisposent à l’atélectasie pulmonaire : risques d'hypoventilation et d’hypoxémie sont donc majorés.
Les réserves respiratoires faibles et la consommation accrue d’oxygène dans les premières semaines de vie, sont compensées au repos par une ventilation par minute bien plus élevée que celle de l’adulte. Elle doit être maintenue en anesthésie et la supplémentation en oxygène est donc obligatoire à chaque instant. Pour limiter la fatigue musculaire et l’augmentation du travail respiratoire que le nouveau-né n’est pas capable de soutenir, on conseille d’avoir recours à la ventilation assistée de façon régulière lors d’une anesthésie générale tout en évitant les barotraumatismes (pression d’insufflation < 8-10 cmH2O et volume courant 6-8 mL à fréquence élevée >15 mpm.
2. Particularités du système cardiovasculaire
Le cœur et en particulier le myocarde, ainsi que les vaisseaux présentent une moindre contractilité ainsi qu’une compliance limitées. La réserve cardiaque est bien plus faible que chez l’adulte avec un volume d’éjection systolique réduit et un débit cardiaque dépendant d’une fréquence cardiaque élevée. Le volume intravasculaire est relativement fixe et le baro-réflexe incompétent au moins jusqu’à 4 semaines. Le système parasympathique rend le jeune plus sensible à la bradycardie qui aggrave le risque d’hypotension. Le très jeune animal compensera mal toute hypovolémie même relative, liée à l’anesthésie, d’autant plus difficile à traiter que les vasopresseurs, inotropes et anticholinergiques sont partiellement inefficaces. Les hémorragies sont mal tolérées (5 mL/kg contre 12-15 chez l'adulte), d'autant que l'hémoglobinémie est plus faible. Les besoins hydriques sont plus élevés et une fluidothérapie adaptée est donc primordiale : débits comparables ou légèrement plus élevés que chez l’adulte en première intention. Cependant, le risque d’hypervolémie est présent à cause de la non compliance des compartiments vasculaire et cardiaque et d’une clairance rénale limitée. Dans les premiers jours/semaines de vie, un souffle cardiaque peut persister avant la fermeture complète des divers foramens. La pression artérielle basale des nouveaux nés est sensiblement plus basse que celles de l’adulte on tolère des pressions systoliques et moyennes de l’ordre de 60 et 40 mmHg respectivement.
3. Particularités des systèmes hépatique et rénal
La néphrogénèse n'est complète qu'aux alentours de 3 semaines et l’excrétion rénale des médicaments se normalise bout de 2 mois, avant quoi débit de filtration glomérulaire et sécrétion tubulaire sont encore diminués. Les variations importantes de volémie dues à un remplissage massif par solutés sont donc mal tolérées et le risque d’accumulation de certains médicaments et métabolites actifs à excrétion rénale existe.
De manière similaire, le tissu hépatique juvénile n’atteint sa maturité qu’au bout de quelques mois. Avant cela, les systèmes enzymatiques ne sont que peu fonctionnels et entrainent une moindre métabolisation et excrétion des médicaments nécessitant un ajustement des doses en plus d’un choix judicieux. Il convient donc d’éviter l’utilisation de médicaments anesthésiques d'action longue et dont le métabolisme est fortement hépatique et/ou l'excrétion rénale. La présence d’une hypoprotéinémie physiologique entraine une augmentation de la fraction libre des médicaments et des effets accrus. Les réserves glycogéniques et lipidiques peu développées expliquent la tendance à l’hypothermie et à l’hypoglycémie peri-anesthésique.
4. Particularités liées à la thermorégulation
Avant l’âge de 3 semaines le contrôle neurologique de la température est incompétent et l’animal incapable de compenser un environnement froid. Le patient pédiatrique est vulnérable à l’hypothermie également du fait de faibles réserves adipeuses, d’un rapport poids/surface diminué, de capacités de frissonnement et vasoconstriction très limitées et de la fonction hépatique immature. Il est donc primordial de lutter précocement et continuellement contre l’hypothermie.
5. Particularités du système nerveux central et périphérique
La barrière hémato-encéphalique est plus perméable chez le nouveau-né que chez l’adulte. L’efficacité des médicaments est accrue et les doses doivent être ajustées d’autant plus que les besoins en anesthésiques volatils sont moindres (MAC diminuée). Pour les mêmes raisons, l’induction gazeuse ainsi que le réveil suite à l’arrêt des agents volatiles est plus rapide que chez l’adulte. Les nerfs périphériques sont également moins myélinisés et plus sensible à l’action des anesthésiques locaux.
6. Diverses considérations
Une mauvaise gestion anesthésique pourrait altérer le développement normal du système sensoriel, en particulier en cas d’hypoxie. La répartition en eau de leur organisme et un compartiment graisseux diminué altère la pharmacocinétique des médicaments sans pour autant qu’aucune grande étude ne permette de mesurer précisément l’extension de ces changements. Ils sont également plus sensibles à l’action des curares. Enfin un mauvais positionnement chirurgical pourrait endommager les plaques de croissance.
III- Mise en place de la procédure anesthésique
Elle commence toujours par l’évaluation clinique, parfois difficile, et une pesée précise du patient pour réajuster les risques déjà évoqués ainsi que ceux inhérents à l’anesthésie à la faveur du contexte clinique et des analyses. On n’oublie pas de mesurer à minima la glycémie, l’hématocrite et la protidémie.
Le risque de surdosage est ici réel et multifactoriel et les recommandations de diminution des doses ne sont souvent basées que sur des extrapolations de ce que l’on sait chez l’enfant, ne garantissant pas l’obtention du juste effet anesthésique recherché. L’idéal reste donc, une administration en titration, évaluant en parallèle effets recherchés et non recherchés, de médicaments d’action courte et par voie IV.
L'élaboration du protocole respecte les mêmes séquences et recommandations que chez l’adulte. La prémédication vise à installer tranquillisation et potentialisation et ainsi qu’une analgésie précoce, multimodale et adaptée en durée et intensité. Les opioïdes, grâce à leurs faibles répercussions cardiovasculaires et de leurs effets sédatifs prononcés chez le jeune, sont la pierre angulaire de la prémédication dans cette population. On peut les combiner avec des benzodiazépines si nécessaire. De manière générale, on proscrit l’acépromazine et les alpha2-agonistes du fait de leurs effets non recherchés mal tolérés.
La voie IV est à privilégier pour l’induction dès lors qu’elle est utilisable pour administrer un inducteur de courte durée d’action, titrables : propofol ou alfaxalone. L’induction par voie inhalée, au masque, est une alternative possible chez le jeune de moins de 2 semaines. Lorsque l’âge augmente, une prémédication préalable en IM est préférable. La mise à jeun inexistante ou très courte et le risque de régurgitation accru justifient une intubation rapide pour protéger les voies aériennes. La stabilité hémodynamique conférée par la kétamine via une stimulation sympathique n’a pas d’effet chez le jeune de moins de 6 semaines. Le système hépato-rénal immature rend son métabolisme plus lent et ses effets, prolongés.
Une maintenance de la narcose par voie inhalée est obligatoire au-delà de 20 minutes, les halogénés étant rapidement éliminés. Dans le cas contraire les médicaments administrés en induction permettent des actes courts et peu invasifs sans ré-administration. L'intubation et la fluidothérapie faisant l’objet d’un TD spécifique, elles ne seront pas développées dans ce manuscript mais sont absolument indispensables au respect des bonnes pratiques. L'apport d'oxygène est obligatoire.
L’évaluation constante des effets recherchés et non recherchés est primordiale mais non spécifique. Une attention particulière devra être portée au niveau de narcose et d’analgésie pour garantir un réveil rapide. Les moyens instrumentaux de surveillance des fonctions cardio-vasculaires et respiratoires sont indispensables à l'établissement d'un diagnostic précoce d’évènements indésirables tels l’hypoventilation, l’hypotension et l’hypoxémie mais la taille de ces dispositifs est souvent mal adaptée. Le suivi de la glycémie est fortement recommandé. Un soutien de la fonction respiratoire est souvent nécessaire. La surveillance de la température et la mise en place de mesures de réchauffement actif sont indispensables à chaque étape puisque l’hypothermie est un enjeu majeur qui sensibilise aux effets narcotiques et cardio-dépresseurs des médicaments. Une attention particulière doit également être portée aux pertes sanguines éventuelles.
Le réveil doit également être surveillé constamment, le patient réchauffé et la glycémie contrôlée afin de raccourcir au maximum la période d’hypovigilance et favoriser une restauration rapide des grandes fonctions, en particulier la reprise alimentaire.
> Anesthésie de la chienne gestante (hors césarienne)
Luca ZILBERSTEIN
Advetia
Vélizy-Villacoublay
I- Introduction
L’anesthésie de la chienne gestante représente un défi pour le vétérinaire, même hors nécessité de césarienne. Pour cela une bonne connaissance de la physiologie est indispensable pour concevoir et optimiser la meilleure stratégie anesthésique possible.
II- Changements physiologiques généraux
Tout au long de la gestation, les besoins métaboliques de la mère augmentent proportionnellement déclenchant des adaptations de fonctionnement dans les divers organes. Bien que la plupart des études soient conduites sur les humains ou sur quelques espèces animales (les ruminants), les adaptations physiologiques sont similaires entre les divers mammifères et coordonnées par la même logique hormonale.
Comme changement « général » la pression exercée par l’utérus qui grandit progressivement, est parmi les plus marquante. Chez nos quadrupèdes, cette augmentation est certainement moins gênante que chez la femme, mais elle peut fortement varier en fonction des races (par exemple chez les brachycéphales) en fonction de la confirmation anatomique et du positionnement de l’animal. Chez nos animaux domestiques (chien et chats) il n’est pas insolite d’avoir des gestations pluripares et, dans certaines races, cela peut donner à des naissances incroyablement prolifiques.
L’adaptation de la fonction cardiovasculaire représente, peut-être, un des facteurs clés du développement. La grossesse affecte la fonction cardiovasculaire via plusieurs mécanismes. Le nombre de fœti nécessite une correspondante et proportionnelle augmentation du volume plasmatique qui détermine à la fois une diminution de l’hématocrite et des protéines totales. Cette dernière (surtout l’albumine) est à l’origine de l’équilibre de la pression oncotique et une diminution de sa concentration produira une baisse de cette dernière. L’albumine est aussi la protéine qui se lie le plus aux anesthésiques (pratiquement tous les anesthésiques, mais en pourcentage différents selon les molécules). Si l’albumine baisse, la fraction libre de l’anesthésique (non lié à l’albumine) augmentera est sera plus actif. L’augmentation du volume circulant est harmonisée par une conséquente augmentation du débit cardiaque et une meilleure perfusion périphérique (légère vasodilatation liée aux œstrogènes). Cela se traduit en un effort cardiaque plus important, tout au long de la gestation. Certains animaux en difficulté cardiaque pourraient, donc, subir une influence négative de cette demande si leur cœur ne peut pas « suivre » l’effort demandé.
Parallèlement l’augmentation du volume abdominal augmente la compression sur les viscères et les vaisseaux. Cette pression peut même se traduire en une occlusion dynamique de la veine cave, lors d’une position dorsale. Ce manque de retour veineux peut produire une hypoperfusion fœtale transitoire. Il est, donc, préférable de positionner l’animal avec une légère rotation axiale pour dévier le poids de l’utérus gestant en dehors de la veine cave caudale.
L’engorgement veineux lié aux œstrogènes se manifeste de la même façon, au niveau du canal rachidien et peut augmenter les effets anesthésiants d’une anesthésie épidurale ou spinale.
L’augmentation du volume abdominale provoque une plus au moins importante compression du diaphragme, en lui empêchant ses mouvements habituels. Du fait du métabolisme augmenté (pour supporter le nouveau bilan énergétique) le volume minute doit augmenter et cela se produit par accélération des actes respiratoires et par élargissement du volume pulmonaire. Cette augmentation est dictée par le besoin en oxygène supplémentaire (environ > 20%). Si cela pourrait sembler incohérent avec l’augmentation du volume abdominal (et relative compression) l’animal arrive bien à gérer cette nouvelle physiologie si aucun empêchement du milieu extérieur s’impose. La respiration sera accélérée et le CO2 diminué à environ 30 mmHg (témoignant d’un état d’hyperventilation). Cet état d’alcalose respiratoire
est parfaitement compensé par une relative acidose métabolique grâce à la réabsorption de HCO3- au niveau rénal. Pour faire place à ce besoin accru en volume courant, la capacité fonctionnelle résiduelle du poumon (i.e. l’air qui resté dans les alvéoles à la fin de l’acte respiratoire) se réduit pour laisser la place au volume courant (Fig.1).
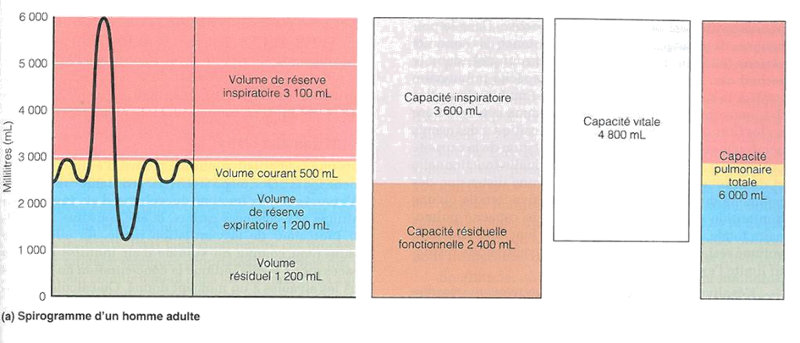
Cela nous oblige à être prêt à l’intubation et oxygénation de l’animal dès que l’anesthésie est induite. La préoxygénation préopératoire, bien que suggérée en d'innombrables textes, est de difficile application et souvent, de ce fait, contreproductive. Mieux vaut être prêt à tout, une fois l’animal endormi, avec possibilité de ventiler le patient et lui supporter son hématose efficacement.
La « règle » que les animaux gestants puissent s’endormir plus rapidement et facilement avec les halogénés, est plutôt controversée. Donc, elle reste déconseillée.
En revanche, il est indéniable que les chiennes gestantes puissent nécessiter d’un niveau de narcose plus bas.
Les raisons sont encore à comprendre dans leur détail, mais certainement les modifications lie aux taux d’œstrogènes-progestérone et endorphines augmentées il y est pour quelque chose.
Cette même « surpression » abdominale produit un ralentissement de la vidange intestinale et gastrique. Le sphincter du cardia est relativement hypotonique et tout cela prédispose la gestante à une plus facile régurgitation et, dans certaines situations, à des vomissements. Aucun antiémétique peut empêcher ce phénomène qui n’est pas induit par une stimulation des centres du vomissement (CTZ, Control trigger Zone), mais c’est juste l’effet d’une « pression ».
Le mieux, dans ces cas à risque, est d’intuber rapidement l’animal de façon sure et d’éventuellement aspirer l’estomac de son contenu avant le réveil de l’animal (mieux le faire tout de suite pour, ainsi, éviter les œsophagites péri-anesthésiques).
La fonction rénale et hépatique sont rarement touchées par la gestation et elles ne nécessitent pas de précautions particulières lors de l’anesthésie. Exception : la gestion de la glycémie péri- gestationnelle.
En effet, en fonction des animaux, la glycémie peut être assujettie à des variations en fonction de l’état métabolique de l’animal. Rarement elle peut être fortement dérangée, mais un éventuel jeune préopératoire (à éviter) pourrait mettre en évidence des hypoglycémies transitoires. Ces dernières restent à traiter de façon classique avec une complémentation de glucose intraveineux et par voie orale, dès que possible.
Pour ce qui concerne le jeune per-opératoire, le meilleur compromis serrait celui de donner une petite dose d’aliment humide quelques heures avant l’intervention (6 heures avant, par exemple). De cette façon il est peu probable que l’estomac se retrouve encore rempli au moment de l’anesthésie et le support glycémique est ainsi assuré.
III- Le protocole anesthésique
De façon « simpliste » nous pouvons affirmer que quasiment tous les anesthésiques traversent (de façon plus au moins variable) la barrière placentaire.
Il est ainsi impossible d’éviter une imprégnation des foeti par les anesthésiques utilisés sur la mère.
La stratégie anesthésique versera, donc, sur les conditions cliniques de la mère et elle devra s’adapter pour réduire le stress des deux parties.
De manière générale et pour toutes les situations, il faut préserver l’hématose, la circulation sanguine optimale et les fonctions métaboliques de la mère (pas d’hypothermie). Ces valeurs, propres à toute anesthésie, sont encore plus importantes chez un individu modifié par les conséquences d’une gestation. Une mise en place d’une ventilation mécanique pendant l’anesthésie est une évidence clinique et le support avec une fluidothérapie doit être optimisé. Des éventuelles anémies ne nécessitent pas forcément de correction (avec tous les risques associés) sauf cas urgent (quand elle se produisent accidentellement et trop rapidement pour que la mère puisse avoir eu le temps physiologique de s’y adapter).
Parmi les molécules « contradictoires » les Alpha2-agonistes sont certainement les plus controversées. Du fait de leur stimulation adrénergique, ces molécules peuvent (en fonction de l’état d’avancement de la gestation) plus au moins stimuler la motilité utérine. Cela est bien plus évident au début de la gestation et à sa fin. Il a été aussi mis en évidence que ce phénomène est molécule- et dose-dépendant. La xylazine (le moins sélectif des alpha2-agonistes) est la plus délétère et les fortes doses (cette fois-ci de tous les alpha2-agonistes) sont certainement à proscrire. Par exemple 60 µg/kg de médétomidine ont montré d’augmenter l’activité électrique de l’utérus, quand 20µg/kg étaient plutôt neutres. Or une dose de 20µg/kg de médétomidine est largement suffisante dans un protocole d’anesthésie balancé, pour calmer et perfectionner un protocole d’anesthésie. Inutile de cherche plus loin pour avoir des complications inutiles.
L’acépromazine, n’est pas directement contreindiquée, mais à cause de ses effets longue durée, non-antagonisables et de vasodilatation/hypotension, est certainement une molécule de dernier choix.
Ainsi toutes les techniques d’anesthésie locorégionales sont à encourager et à optimiser. Ces dernières influencent que très peu la vitalité des foeti ou leur bien-être. Certes une épidurale lombo-sacrée avec une anesthésie locale peut produire une vasodilations du train postérieur qui nécessitera une compensation volémique, mais cela est certainement moindre par rapport à un abus d’anesthésiques par voie générale.
Parmi les anesthésiques utilisés pour l’induction, le propofol, utilisé proportionnellement, semble rassembler toutes les caractéristiques idéales. La vasodilation induite est dose dépendante et peut être facilement compensée. La kétamine (à bas dosages) maintient la performance cardiaque et peut être associée dans le protocole d’induction. Il est préférable d’en réduire le dosage (1 ou 2 mg/kg) à cause de son passage et permanence dans les foeti. Un compromis idéal pourrait être l’association de kétamine et propofol, en association avec des faibles doses de midazolam, pour obtenir l’induction et la narcose du patient.
Pour le maintien les halogènés (type sévoflurane ou, en deuxième lieu, l’isoflurane) peuvent être utilisées, même si leur tératogénicité n’a pas été vraiment étudiée dans le monde animal. En effet tous les anesthésiques peuvent être potentiellement tératogènes, avec la place de leader pour le protoxyde d’azote (n'est désormais plus utilisé).
Les effets tératogènes sur le monde humain ne peuvent pas être transposés dans le monde animal (exemple le diazépam qui produit sur les enfants de fentes palatines). Il nous reste, donc, à utiliser la plus grande sagesse et administrer uniquement ce qui est nécessaire et aux plus bas dosages.
Parmi les antalgiques, les molécules à proscrire sont les AINS du fait de leur effets inhibiteur sur les prostaglandines. Les prostaglandines sont indispensables pour le développement embryonnaire rénal et d’autres organes. Leur présence dans la mère (et donc dans le fœtus) représente le risque de nuire à ce développement. Même si rien n’est mathématiquement prouvé, leur usage est déconseillé.
Les opioïdes ne produisent pas de dommage fœtal du fait que l’oxygénation dépend de la ventilation et circulation de la mère. À l’état actuel des connaissances vétérinaires, il est impossible d’imaginer tous les multiples effets que les opioïdes pourraient avoir sur les foeti, la totale absence de rapports scientifiques dans telle direction est plutôt rassurante.
IV- Conclusion
L’anesthésie de la chienne gestante nécessite la plus grande maitrise dans le choix des produits et dans les adaptations des techniques anesthésiques. Le contrôle de la volémie, de l’oxygénation et le positionnement du patient seront la clé du succès pour réussir l’acte.
